Технические характеристики
| Техническое наименование | ацетилен технический растворенный |
| Химическая формула | С2H2 |
| Номер по списку OOН | 1001 |
| Класс опасности при перевозках | 2.3 |
Физические свойства
| Физическое состояние | хранится в баллонах в виде раствора в ацетоне |
| Плотность, при нормальных условиях (101,3 кПа, 20 °C) кг/м³ | 1,177 |
| Температура кипения, °С при 101,3 кПа | -83,6 |
| Температура тройной точки и равновесное ей давление °С, мПА | -80,7 (0,128) |
| Растворимость в воде | ацетилена незначительна; ацетона неограничена |
| Пожаро- и взрывоопасность | пожаро-взрывоопасен |
Стабильность и химическая активность
| Стабильность | нестабилен |
| Реакционная способность | Активно горит в кислороде и других окислителях. Способен к взрыву в среде ацетилена за счет разрыва внутр. связей |
Опасность для человека
| ПДК, мг/м³ | 500 |
| Токсическое воздействие | малотоксичен |
| Экологическая опасность | образует взрывчатые смеси с воздухом |
| Средства пожаротушения | применимы любые огнетушащие средства |
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
 Сварка при помощи ацетилена
Сварка при помощи ацетилена
 Пламя при ацетиленовой сварке
Пламя при ацетиленовой сварке
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм3/час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм3/час, при правом 650-750 дм3/час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.

Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
Ацетилен в условиях нормальной влажности воздуха и температуры является бесцветным газом, который получают в стационарных генераторах методом действия воды на карбид кальция. При понижении температуры до -85 градусов по Цельсию вещество переходит в твердое состояние, одновременно с этим образуются кристаллы. Важным свойством ацетилена является то, что при ударах или под воздействием трения он взрывается. Этот параметр во многом определяет область использования.
Производство карбида кальция
Дешёвое производство карбида кальция и лёгкое получение из него ацетилена немедленно придало газу коммерческую ценность.
При производстве карбида кальция в дуговой электропечи применяется известь и кокс как можно более высокой чистоты. Хорошая рабочая смесь этих материалов — 100 весовых извести на 68 весовых частей кокса. На каждый килограмм выхода карбида кальция идёт 1,8 кг рабочей смеси.
Существует два основных промышленных способа получения карбида кальция электродуговым способом — получением слитков и постепенным выпуском.
При первом методе (получение слитков карбида кальция) известь и кокс мелко размалывают и тщательно перемешивают в нужной пропорции. Электрод устанавливается в тигле, частично наполненным рабочей смесью, при возникновении дуги со дна тигля начинает постепенно образовываться слиток карбида кальция, причём угольный электрод постепенно поднимается для компенсации падения сопротивления укорачивающейся дуги, которая касается растущего слитка.
По мере роста слитка в тигель продолжают подсыпать рабочую смесь. Сам тигель изготовлен из металла и его объём значительно больше, чем объём получаемого слитка — таким образом масса нерасплавленной смеси защищает стенки тигля от высокой температуры дуги. Когда слиток достигает заданной величины, тигель вынимают из установке и заменяют его другим. Таким образом процесс изготовления карбида не является непрерывным, но смена тигля занимает всего две или три минуты и происходит каждые 10–15 часов.
Преимущество этого метода в том, что кокс и известь нагреваются только до точки реакции, и готовый карбид не «варится» после этого. Слиток почти полностью состоит из кристаллического карбида кальция, но поверхность его покрыта коркой из не полностью прореагировавших компонентов рабочей смеси. Так как это снижает выход ацетилена на единицу массы продукты, перед упаковкой в герметичную влагостойкую тару слитки механически очищают от этой корки.
Данные относительно выхода карбида на киловатт-час затраченной энергии несколько разнятся. Например, если «из печи» его указывают как 0,230 кг, то после чистки слитков, их дробления, сортировки и упаковки эта цифра снижается до 0,185 кг карбида кальция на киловатт-час электроэнергии.
При втором методе производства (постепенным выпуском расплавленного карбида) используется неподвижный тигель, футерованный графитом и электрод, чей размер почти совпадает с размером тигля. При этом сила тока, подаваемого на электрод, намного выше. Рабочая смесь, находящаяся в тигле, нагревается до полного её расплавления и сливается отдельными порциями через короткие промежутки времени. При этом процессе не остаётся непрореагировавших материалов и сам процесс технически проще, но сама установка — намного дороже.
Тем не менее, плавленый карбид кальция не так чист, как карбид в слитках, потому что в смесь для его получения приходится вводить излишек извести, которая действует как флюс. Следовательно, и объём выделяемого ацетилена у такого карбида меньше.
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели — например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
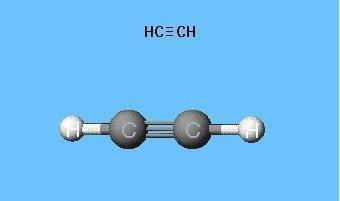
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Оборудование и материалы для ацетиленовой сварки
При газовой сварке в качестве горючего газа чаще всего применяется ацетилен, но из-за ряда причин его так же и заменяют другими газами. Кроме того ацетилен является не единственным газом и расходным материалом, который необходим для получения качественного соединения металлов.
Расходные материалы при газовой сварке
Ацетилен или заменяющий его газ
Он может быть в готовом виде (в баллоне), а так же в получаемом при разложении жидкости под действием электродугового разряда или при разложении карбида кальция водой. Остальные газы-заменители с низкой теплопроводностью применяются для отдельных металлов в качестве раскислителей. На их сгорание требуется разное количество кислорода, но они не являются экономичными.
Кислород
Для обеспечения достаточных температур и быстрого расплавления металлов пары горючих газов или сам газ сжигается с добавлением чистого кислорода. Для сварки используют технический кислород трех сортов, который оценивается по объему при атмосферном давлении:
- высший сорт — частота 99.5% + 0.5% азот;
- первый сорт — частота 99.2% + азот, аргон;
- второй сорт — частота 98.5% + азот и аргон.
Жидкий кислород при сварке не используется, но он более удобен и безопасен для транспортировки в теплоизолированных емкостях.
Присадочная проволока
Сварочная проволока используется в соответствии с химическим составом свариваемых металлов. Главным критерием ее подбора является температура плавления, которая должна быть чуть ниже температуры плавления металлов. В виде исключения для стали, меди, латуни и свинца проволока может быть заменена нарезанными тонкими полосками металла той же марки.
Флюсы
Сварочные пасты или порошки, называемые флюсами, применяются при сварке ацетиленом и его заменителями для защиты расплавленного металла от окисления и быстрого удаления уже образовавшихся пленок-окислов.
Проволока и края металлов обрабатываются флюсами, которые при нагреве образуют шлаки и всплывают на поверхность жидкого металла. Шлаковая пленка защищает сварочную ванну жидкого металла от окисления. выбор состава флюсов, как и присадочная проволока, зависит от вида свариваемых металлов.
Аппаратура для сварки
Применение газовой сварки требует одинакового набора аппаратуры вне зависимости от вида используемого горючего газа. Основным набором сварщика на сварочном посту является:
Водяной затвор. Он необходим для предотвращения воспламенения ацетилено-кислородной смеси в газовых каналах при так называемом обратном ударе. Защитный затвор всегда подсоединяется между горелкой или резаком и газопроводом к баллону или ацетиленовому генератору.
- Ацетиленовый генератор. Используется для получения ацетилена из карбида кальция путем добавления воды.
- Баллоны. Стальные бесшовные сосуды с запорным вентилем. Они необходимы для сжатого кислорода, а так же ацетилена, который находится под давлением и растворен в ацетоне. Все баллоны различаются по цветам.
- Вентили для баллонов. Используются только латунные для кислородных баллонов и только стальные для ацетиленовых. Запрещается использовать медь, так как ацетилен и медь образуют взрывчатое соединение.
- Редукторы. Используются для понижения давления отбираемого из баллона ацетилена и поддержания его на необходимом уровне. По конструкции они бывают однокамерные и двухкамерные.
- Рукава (шланги). Для подачи газа применяются шланги из вулканизированной резины и прокладками из ткани. Рукава для ацетилена и кислорода отличаются, но можно использовать и трубопровод с защитным клапаном.
- Газовые горелки. При ручной газовой сварки используются разнообразные горелки, которые необходимы для смешивания кислорода и ацетилена, то есть для регулировки мощности пламени.
Средства защиты сварщика и инструмент. Сварочная маска, очки, рукавицы, ключи баллонные, молоток и щетка по металлу для зачистки сварных швов.
Весь этот набор оборудования и расходных материалов является обязательным, но не минимальным. Для кислородной резки используют еще и горелку-резак. Из-за опасности проведения сварочных работ взрывоопасной смесью все оборудование должно проходить регулярные проверки и быть в полной исправности.
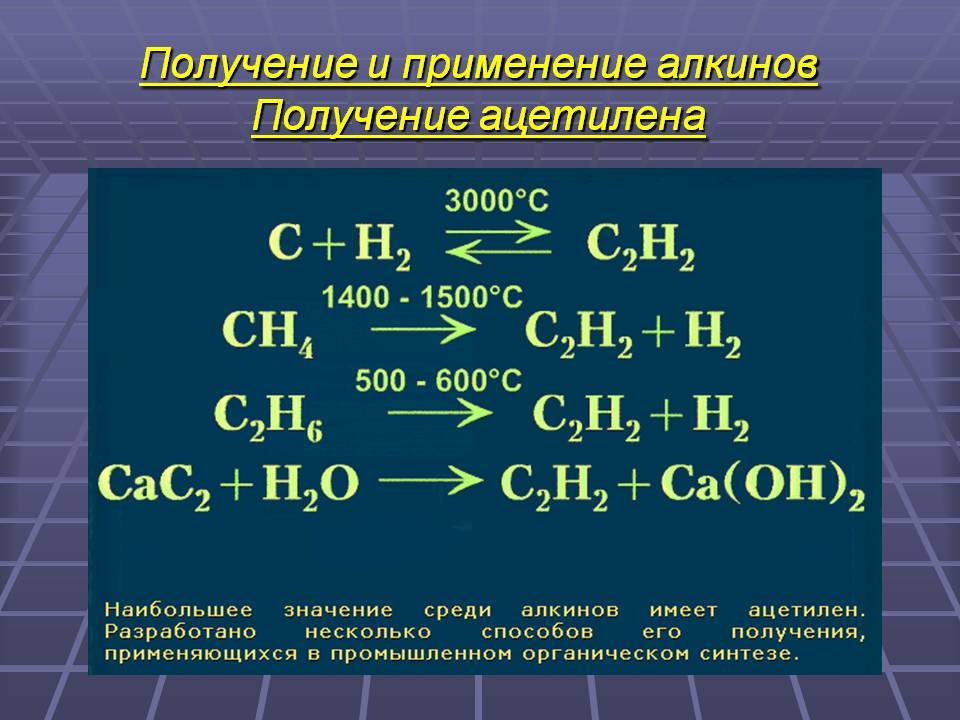
Получение ацетилена
Ацетилен можно получить в малых количествах – в лабораториях, а также в промышленных масштабах. Получение ацетилена является не сложным по химическому процессу, но ответственным технологическим мероприятием.
Разберем все основные способы синтезирования ацетилена подробнее.
В лаборатории
Лабораторный метод применяется в случаях, когда необходимо получить небольшую порцию чистого ацетилена для опытов и при этом контролировать процесс его синтезирования на каждом из этапов.
Суть метода сводится к следующему – на заведомо подготовленный и уложенный в пробирку карбид кальция проливают небольшое количество простой воды. В процессе бурно протекающей химической реакции будет выделяться чистый газ – ацетилен который можно сразу же из пробирки применять по назначению.
Контроль процесса сводится к визуальному наблюдению и при необходимости прекращению реакции с помощью раствора поваренной соли.
В промышленности
Промышленный метод намного более сложен по своему составу и технической оснащенности, но он рассчитан на получение ацетилена в количествах способных удовлетворить потребности производственных мощностей.
Как правило, ацетилен полученный промышленным методом содержит большое количество различных примесей и не годится для химических опытов и изучения состава.
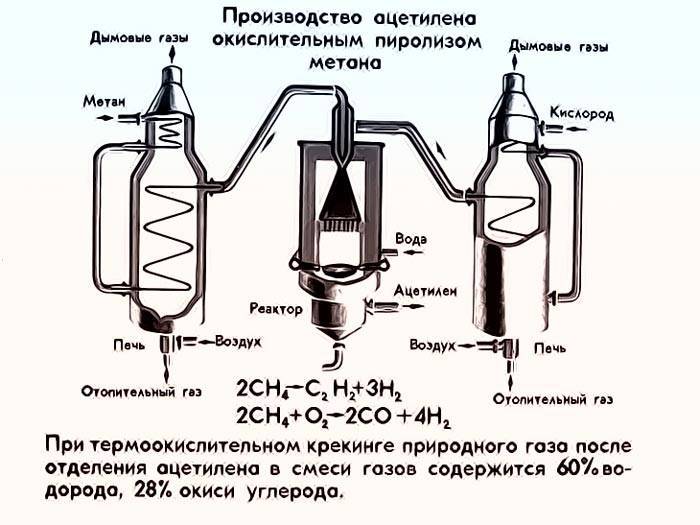
Получение пиролизом
В отличие от карбидного метода, метод получения ацетилена пиролизом не требует больших затрат на производство. Процесс пиролиза сводится к работе двухконтурного реактора, который необходимо постоянно подогревать.
Подогрев реактора осуществляется в меньшей части подведением электрической энергии, и в большей степени химическим процессом рециркуляции синтезируемого газа первого контура.
Полученный таким образом ацетилен дешев в производстве, но не отличается химической чистотой.
Карбидный метод
Карбидный метод на производстве применяют тогда, когда необходимо получить большое количество химически чистого ацетилена. Этот метод чрезвычайно дорог и требует потребления большого количества электроэнергии.
К положительным сторонам карбидного метода можно отнести чистоту получаемого газа и техническую простоту применяемого оборудования.
Как синтезировался ацетилен
Впервые ацетилен был получен в 1836 году, но учитывая более ранние представления о химических процессах и атомарном строении кристаллической решетки газа, назван он был «Ацетилом».
В последствии, когда рассматриваемый химический элемент научились создавать уже несколькими способами, знаменитым Французским химиком Марселеном Бертло было предложено название «Ацетилен». Примечательно, что впервые синтезированный ацетилен был получен именно «карбидным» методом.
Электрический крекинг
Электрическим крекингом называется процесс нагрева метана и последующего превращения его в ацетилен. Электричество играет здесь роль носителя энергии с помощью которого метан разогревают в электродуговой печи.
Для успешного протекания реакционного процесса нагрев печи должен достигать более 3000 °C, что ведет к большому расходу электроэнергии. На синтезирование всего тонны готового ацетилена затрачивается от 10 до 15 кВт, что является существенным недостатком и ведет к удорожанию химического производства.
Пиролиз окислительный
Довольно интересный процесс производства, химическая основа которого идентична электрокрекингу. Отличие заключается в том, что предварительно подготовленную часть метана окисляют кислородом и полученное соединение nac cna сжигают в первом контуре реактора.
Выделенное в результате сжигания тепло идет на разогрев метана во втором контуре реактора и производство ацетилена. Такой способ приводит к хорошей экономии электроэнергии, но более технически сложный и требует большого количества метана.
Преимущества
Газ является непредельным углеводородом, который обладает тройной связью атомов углерода. Формула ацетилена – С2Н2. При этом структурная формула ацетилена выглядит следующим образом Н-С=С-Н, так как связь идет между атомами углерода.
Химические и физические свойства
В нормальных условиях газ является бесцветным. Он легче воздуха. В техническом ацетилене имеются добавки, которые придают ему резкий запах, но в чистом виде он ни чем не пахнет. Лучше всего газ растворяется в ацетоне, но в воде он мало растворим. Температура кипения достигает -83,6 градусов Цельсия.
Газ требует очень аккуратного обращения. Баллон может взорваться от обыкновенного удара при падении или при нагреве около 500 градусов Цельсия. Воспламениться струя может даже от статического электричества от пальца человеческой руки. Молярная масса ацетилена составляет 26 г/моль. Температура горения ацетилена в ядре пламени может составлять более 2600 градусов Цельсия.
Химические свойства ацетилена показывают, в какие реакции может вступать субстанция с другими веществами. В присутствии катализаторов, в частности солей ртути, газ образует уксусный альдегид. Благодаря наличию тройной связи, молекулы вещества имеют большой запас энергии. Это обеспечивает ей высокую теплоту сгорания, которая составляет 14 000 ккал/м3. Если при сгорании добавить струю кислорода, то температура пламени достигнет более 3100 градусов Цельсия. Газ может полимеризироваться в такое вещество как бензол и прочие органические соединения, к примеру, винилацетилен или полиацетилен. Полимеризация в бензол происходит при температуре в 500 градусов Цельсия и при наличии графита. Если в качестве катализатора использоваться трикарбонил никеля, то данная реакция может пройти при температуре в 65 градусов Целься. Ацетилен обладает очень сильными кислотными свойствами. Атомы водорода могут легко отщепиться в качестве протонов. В эфирном растворе металмагнийбромида данный газ вытесняет метан. В сочетании с солями одновалентной меди и серебра ацетилен образует взрывчатый нерастворимый осадок.
Состав
Горение ацетилена и прочие его практические свойства во многом зависят от состава. Даже небольшие отклонения от нормы могут привести к тому, что газ поменяет свои характеристики. Поэтому, выделяют несколько основных сортов, отличающихся друг от друга по своему составу.
Состав ацетилена газообразного технического:
- Основной газ – 98,5%;
- Воздух – 1,4%;
- Фосфорный водород – 0,08%;
- Сероводород – 0,05%.
Растворенное вещество первого сорта марки Б должно обладать следующим составом:
- Основной газ – 99,1%;
- Воздух – 0,8%;
- Фосфорный водород – 0,02%;
- Сероводород – 0,005%.
Растворенное вещество второго сорта марки Б должно обладать следующим составом:
- Основной газ – 98,8%;
- Воздух – 1%;
- Фосфорный водород – 0,05%;
- Сероводород – 0,05%.
Растворенное вещество марки А должно обладать следующим составом:
- Основной газ – 99,5%;
- Воздух – 0,5%;
- Фосфорный водород – 0,005%;
- Сероводород – 0,002%.
Технология и режимы сварки
Перед началом сварки нужно подобрать баллон с ацетиленом и понять саму его конструкцию.
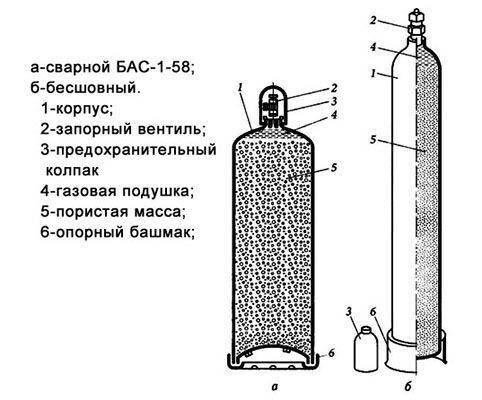
Конструкция баллона с ацетиленом
Потом подбирается горелка требуемого размера от 0 до 5. Толщина этого инструмента определяет расход газа, а также ширину образуемого шва. Чтобы проверить готовность изделия к работе, ее нужно продуть ацетиленом до тех пор, чтобы почувствовать его запах.
Поджог газа осуществляется еще до добавления кислорода. После загорания можно добавить понемногу струю кислорода, пока не образуется устойчивое пламя. Выходное давление основного газа должно быть до 4 атмосфер, а дополнительного – до 2 атмосфер. Затем подбирается мощность пламени согласно толщине свариваемого металла.
Заранее очищенные заготовки предварительно прогреваются пламенем горелки до нужной температуры. После этого добавляется сварочная проволока, которая вместе с основным металлом образует сварочную ванну. Процесс сварки может проводиться как правым, так и левым способом. После окончания процедуры горение ацетилена поможет постепенному охлаждению шва с подогревом.
Заключение
Разбираясь, для чего нужен ацетилен в сварочной области, в первую очередь нужно думать о безопасности. Отличные практические качества и низкая стоимость газа не позволяют отказаться от него полностью из-за взрывоопасности. Любой специалист может оценить все преимущества работы с ним, но сложности хранения затрудняют его применение в домашних условиях.
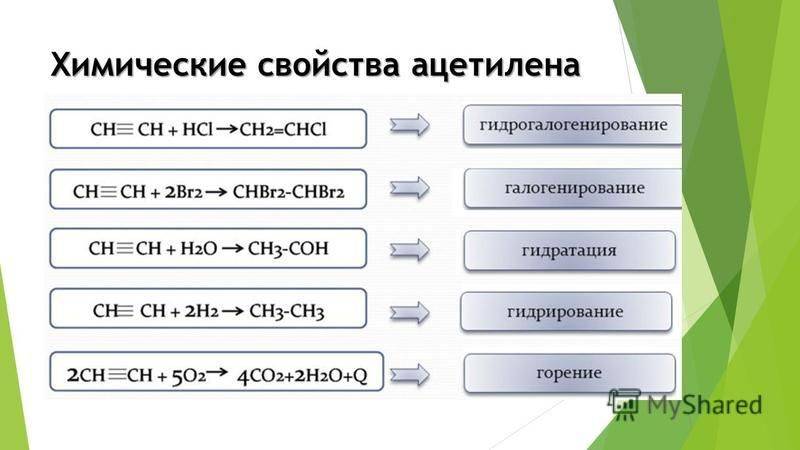
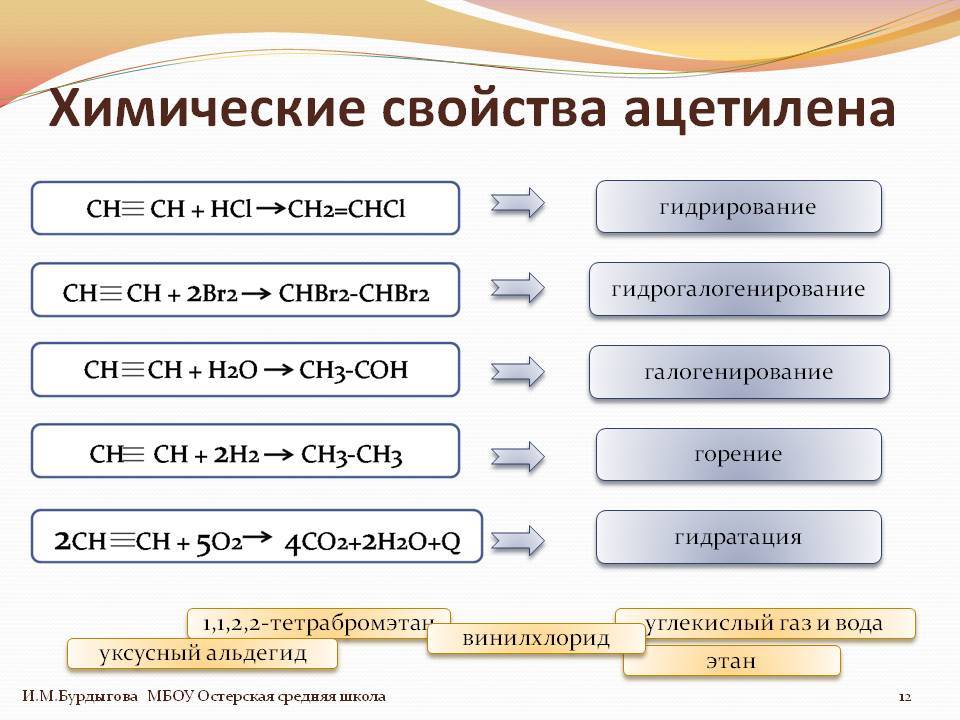
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
Реакции присоединения:
Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
Присоединение синильной кислоты.
CH≡CH + HCN → CH2=CH-CN
Реакции замещения:
Взаимодействие ацетилена с металл-органическими соединениями.
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
Взаимодействие с комплексными солями меди и серебра.
Взаимодействие с амидом натрия.
CH≡CH + 2NaNH2 → NaC≡CNa + 2NH3
Реакции полимеризации:
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор — соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл — циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
Это далеко не все химические свойства ацетилена.
Ацетилен сегодня: способы получения
В промышленности ацетилен часто получают действием воды на карбид кальция. Сейчас широко применяются методы получения ацетилена из природного газа – метана: электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа 5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды 5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен 5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном 5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде 5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана 5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола 5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода 5) реагирует с азотом
Определение алкинов, формула, основные химические свойства
Алкины (углеводороды ряда ацетилена)
представляют собой химические вещества из группы углеводородов алифатического ряда, которые содержат одну тройную связь -С≡С-.
Общая формула алкинов СnH2n-2.
Самым простым представителем алкинового ряда является ацетилен (этин) С2Н2.
Согласно заместительной номенклатуре IUPAC названия ацетилен углеводородов образуются по названию соответствующих алкана, при этом следует заменить суффикс -ан на -ин (-ин) с обозначением положения тройной связи в цепи углеродных атомов.
Нумерацию атомов карбона начинают с того конца, к которому ближе всего находится тройная связь, например, СН3СН (СН 3) С≡ССН3 – 4-метилпентин-2.
Читать также: Ресивер для видеокамеры наружного наблюдения
По рациональной номенклатуре углеводороды ацетиленового ряда или алкины называют производными ацетилена, в эмпирической формуле которого атомы водорода замещаютя на радикалы: НС≡С-СН 2 СН 3 – этилацетилен.
Изомерия ацетилен углеводородов связана с положением тройной связи и разветвлением углеродной цепи. Алкины С2-С4 – это газы, С5-С16 – жидкости, а начиная с С17 – твердые субстанции.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Меры безопасности при работе с ацетиленом
Ацетилен – бесцветный горючий газ C2 H2 с атомной массой 26,04, немного легче воздуха. Обладает резким запахом.
Ацетилен самовоспламеняется при температуре 335° С, смесь ацетилена с кислородом воспламеняется при температуре 297–306° С, смесь ацетилена с воздухом – при температуре 305–470° С.
Ацетилен взрывоопасен при следующих условиях:
- при увеличении температуры более 450–500° С и давления более 1,5–2 ат (около 150–200 кПа);
- при атмосферном давлении ацетилено-кислородная смесь с содержанием ацетилена от 2,3 до 93% взрывается от искры, пламени, сильного местного нагрева и др.;
- при аналогичных условиях смесь ацетилена с воздухом взрывается при содержании в ней ацетилена от 2,2 до 80,7%;
- в результате длительного соприкосновении ацетилена с серебром или медью образуется взрывчатое ацетиленистое серебро или медь, взрывающиеся при повышении температуры или ударе.
Взрыв ацетилена способен вызвать значительные разрушения и тяжелые несчастные случаи: при взрыве 1 кг ацетилена выделяется примерно в два раза больше тепла, чем при взрыве 1 кг тротила и примерно в 1,5 раза больше, чем при взрыве 1 кг нитроглицерина.
Правила
- содержание ацетилена в воздухе рабочей зоны необходимо непрерывно контролировать автоматическими приборами, сигнализирующими о превышении допустимой взрывобезопасной концентрации ацетилена в воздухе, равной 0,46%;
- при работе с ацетиленовыми баллонами поблизости не должно быть открытого пламени или отопительной системы; запрещается работать с баллонами, находящимися в горизонтальном положении, с незакрепленными баллонами, с неисправными баллонами; необходимо использовать неискрящийся инструмент, освещение и электрическое оборудование только во взрывобезопасном исполнении;
- в случае обнаружения утечки ацетилена из баллона (по запаху и звуку) необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом;
- при нагреве баллон с ацетиленом может взорваться с крайне разрушительными последствиями; в случае пожара необходимо по возможности удалить из опасной зоны холодные баллоны с ацетиленом, оставшиеся баллоны постоянно охлаждать водой или специальными составами до полного остывания; при загорании ацетилена, выходящего из баллона, необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом и поливать баллон водой до полного остывания; при сильном возгорании пожаротушение необходимо производить с безопасного расстояния; при пожаротушении рекомендуется применять огнетушители с содержанием флегматизирующей концентрации азота 70% по объему, диоксида углерода 57% по объему, водяные струи, песок, сжатый азот, асбестовое полотно, токораспыленную пену и воду; при тушении сильного пожара используются огнезащитные костюмы, противогазы и т. п.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
Читать также: Из чего состоит ручной лобзик
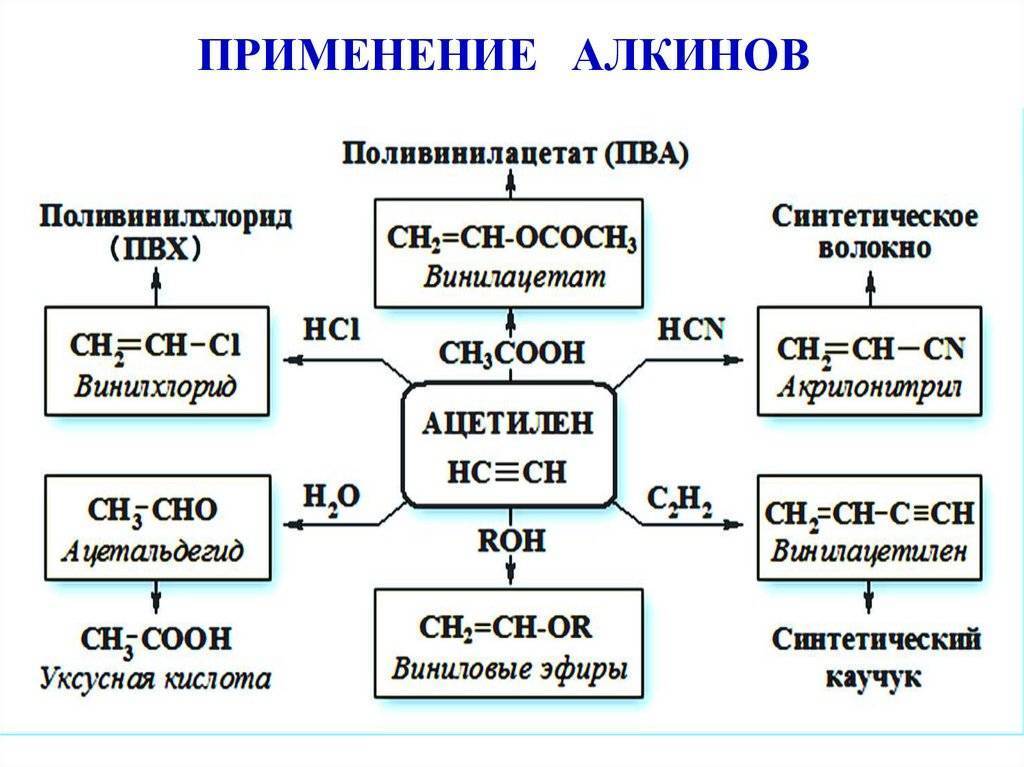
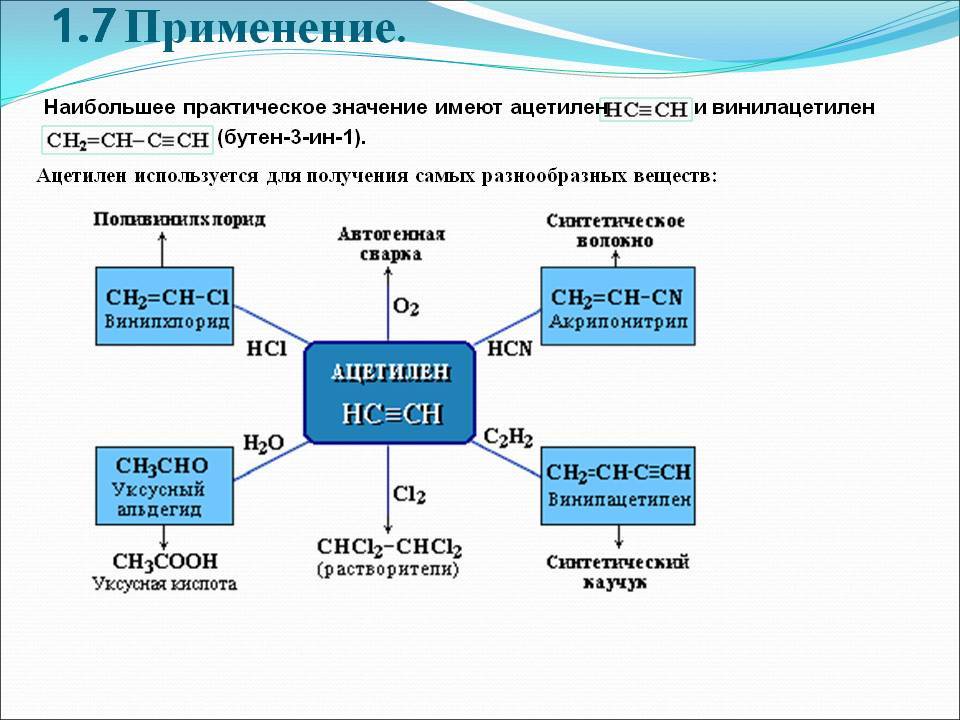
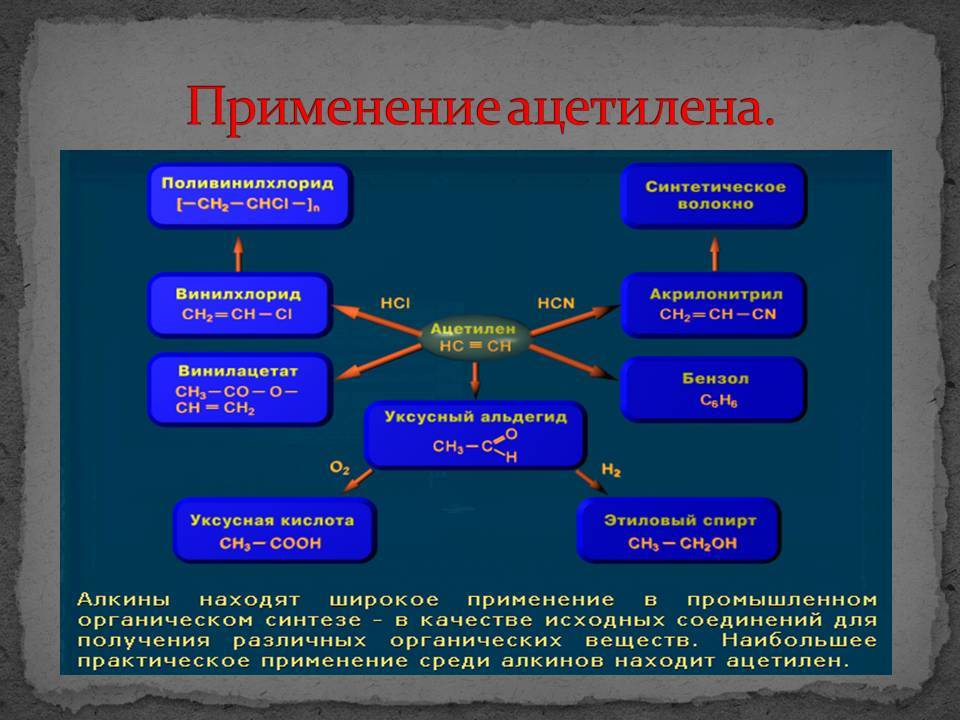
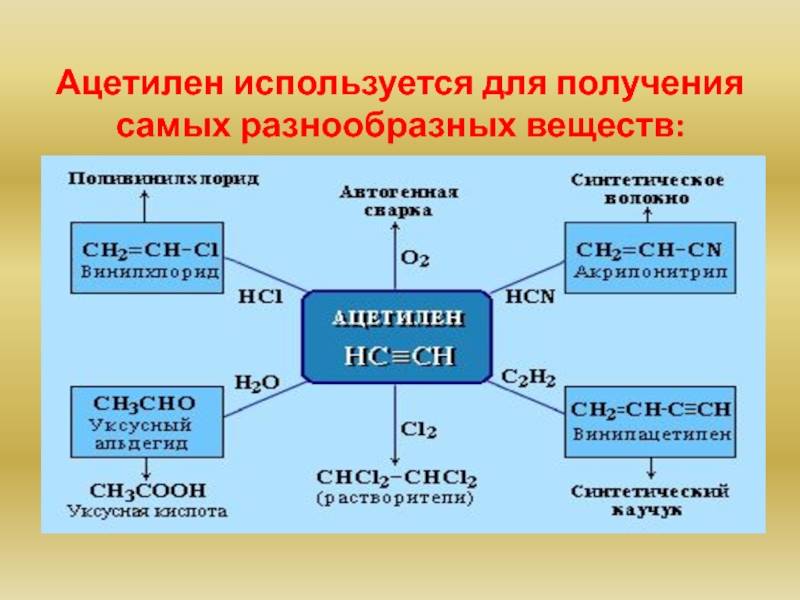
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой
Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом