Лабораторный опыт получения ацетилена
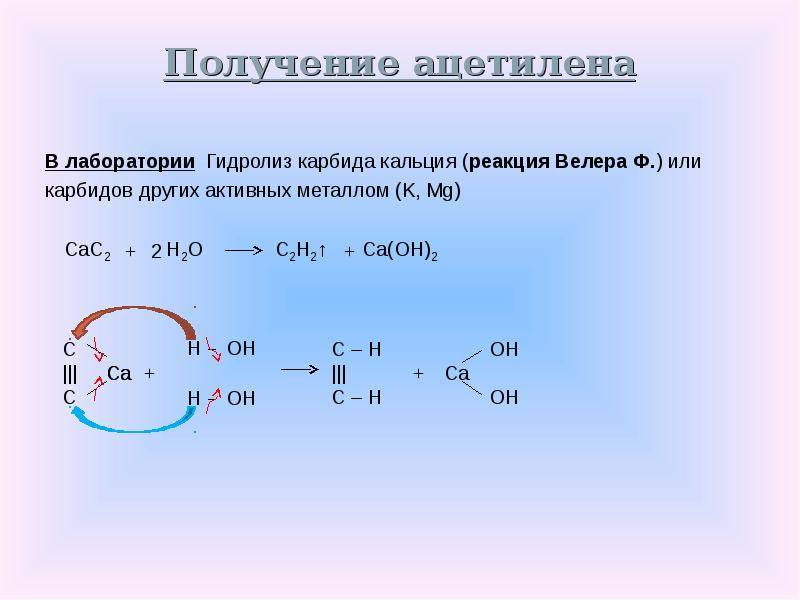
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли
Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот
Что такое «карбид», знает любой мальчишка. Если бросить кусочек карбида в лужу, то кроме дикого шипения получается еще дичайшая вонь. А как получается сам карбид?
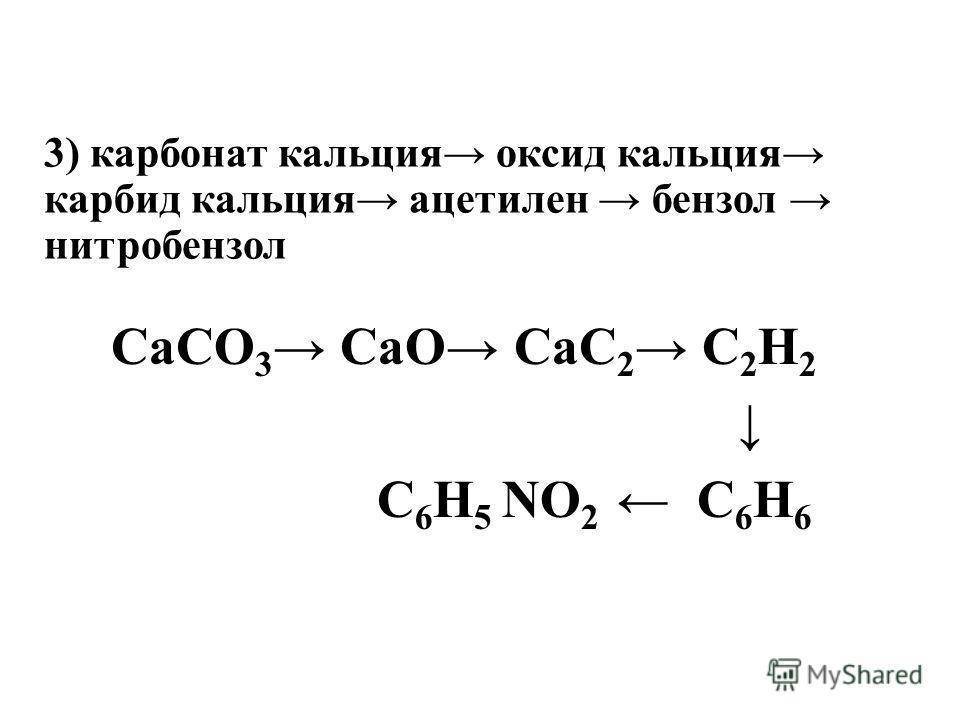
Вообще карбидов существует множество, как и применений ему. Но нас пока интересует карбид кальция CaC 2 — то есть тот, который используют для получения ацетилена при соединении карбида с водой.
Слишком сложного в получении карбида кальция нет. Сейчас для этого в электропечах пережигают негашеную известь с коксом. При всей этой простоте — впервые карбид кальция был получен в лаборатории в 1836-м году, а промышленно его начали получать в 1892 году. Для попаданца — широчайшее поле для внедрения!
Все реакция — CaO + 3C = CaC 2 + CO Негашеная известь соединяется с углеродом. Негашеную известь получали с древних времен, пережигая известняк, ну и древесный уголь тоже дефицитом не был никогда. Полученный попутно угарный газ (СО) окисляется до углекислого газа прямо при выходе из печи, хотя сейчас часто печи делают закрытыми для сбора угарного газа. На 100 весовых частей негашеной извести нужно 70-80 весовых частей углерода. При производстве лучше иметь избыток угля, чем извести — такой карбид отдает больше ацетилена. Готовый карбид кальция технического качества почти на 80% состоит из самого карбида кальция, 17% — известь, остальное примеси. Карбид выходит в виде расплава, который после затвердевания измельчают.
Но, несмотря на простоту реакции получения, есть некоторые неприятные нюансы. Главное — процесс этот эндотермический, он поглощает дикое количество тепла в процессе производства — 3000 кВт на тонну продукта. Именно из-за этого его делают электродуговым способом. При этом сам процесс идет в жидкой фазе — то есть расплавленная известь постепенно реагирует с кусками углерода. При этом нужна температура примерно 2000°С, что совсем немало. И что совсем неприятно — при перегреве до 2200-2400°С карбид кальция распадается на составляющие.
Поэтому, если нам не доступно электричество в больших объемах, у нас есть два выхода.
Первый — это плавить в тигле. Проблема в том, что тигель должен выдержать эти самые 2000°С, а в древние времена ни графитовый, ни вольфрамовый тигель нам будут недоступны.
Второй — построить небольшую доменную печь. Требуемое тепло даст избыточное количество угля. Уголь и известь насыпаются туда слоями и печь поддувается большим количеством воздуха. Такие печи пытались строить и главная проблема — поддержка точных условий реакции, что регулируется силой поддува. С одной стороны — такую печь можно построить только когда уже работают доменные печи для железа. А с другой стороны — а нам точно нужен карбид, если нет даже железа?
Трудность вызовет хранение карбида. Он должен быть абсолютно изолирован от воды — много лучше, чем порох. Потому что если порох намокнет, то он не взорвется, а если намокнет карбид — то взрыв обеспечено. И что хуже всего — при хранении не должна использоваться медь, серебро или золото.
Проблем с производством карбида будет немало. Но при каком производстве их будет мало? Зато все проблемы — решаемые чуть ли не с технологиями Древнего Египта. А пользы от карбида будет много…
И последнее — ацетилен, который получается после контакта карбида с водой — ничем не пахнет, человек просто не имеет обонятельных рецепторов для него. Та вонь, по которой мы безошибочно определяем карбид — это примеси, которых в техническом карбиде несколько процентов.
Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
- Материал необычайно твердый. По этому показателю он почти догнал алмаз. Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения.
- Чтобы расплавить камень, нужно будет приложить немало усилий. Ведь для этого необходимо нагреть его до 2-х, или даже 3-х тысяч градусов Цельсия. Эта цифра будет выше значений, необходимых для того, чтобы изменить состояние металлических веществ, до того, как они оказались в составе карбида.
- Это очень «не контактное» соединение. Так, реакция карбида на очень многие вещества будет нулевой. Для этого нужны особые условия. Потому кислоты, и прочие вещества, способствующие коррозии, им не страшны.
- Но предыдущий пункт не касается воды. Как Вы уже поняли из рассказа выше, карбид и вода – часто идут рука об руку. В случае, к примеру, когда задействован карбид кальция, для этого подойдет абсолютно любая влага, не нужно никаких условностей. Если же в работе карбид кремния, то без нагрева никак – нужен раскаленный пар (1800 градусов).
Науке известны три разновидности таких соединений:
Что их отличает, так это очень прочные связи между атомами. Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
Солеобразные, либо ионные
Здесь в контакт с углеродом вступает либо алюминий, или металл, но не абы какой, а только из 1-2 групп хим. таблицы. Придать такому соединению жидкую форму все еще не очень просто, нужен предельный нагрев. А вот кислота незамеченной не останется, в результате такой «встречи» карбид распадется.
Получаются они из металлов, относящихся к 4-8 группе, сюда же идут кобальт, а также никель, ну и, конечно, железо. Если рассматривать их химическое строение, увидим, что атомы углерода буквально разбросаны, между ними нет связей, они словно вкрапления в образовавшихся в металле пробелах. Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Карбид кальция — Сварка металлов
Карбид кальцияК
атегория:
Сварка металлов
Карбид кальция
В настоящее время ацетилен в промышленных масштабах получается почти исключительно из карбида кальция СаС2 при взаимодействии его с водой. Другие методы получения ацетилена, например из нефти при обработке ее дуговыми разрядами, пока пе получили широкого применения.
Карбид кальция получается в расплавленном виде и периодически выпускается из печи в формы, где, затвердевая, образует слитки-блоки. Расход электроэнергии на 1 т карбида кальция равен 3000—4000 кет-ч для мощных промышленных печей. Карбид кальция производится в больших размерах на крупных карбидных заводах для сварки и резки металлов, химических производств и других целей. Блоки карбида после остывания Дробят и сортируют по величине кусков. Товарный карбид выпускается семи грануляций, от 2—4 до 80—100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергичного разложения водой, перегрева и опасности взрыва.
Гранулированный карбид упаковывают в барабаны из тонколистового железа, герметически закрывающиеся, барабан вмещает 100—120 кг карбида. Технический карбид содержит 10—15% примесей, преимущественно непрореагировавших угля и извести; 1 кг химически чистого СаС2 дает около 370 л ацетилена С и 760 мм рт. ст.). Технический карбид по действующему плавающего колокола (рис. 1).
В генераторах среднего давления, до 3000 мм вод. ст., газгольдер устроен по принципу сообщающихся сосудов, верхний резервуар открыт и сообщается с атмосферой (рис. 2). Давление ацетилена не остается постоянным и зависит от количества его в газгольдере. С увеличением количества ацетилена разность уровней верхнего и нижнего резервуаров и давление ацетилена возрастает, с уменьшением количества ацетилена в газгольдере давление его снижается. У генераторов с давлением свыше 3000 мм вод. ст. (0,3 кГ/см2) газосборником обычно является резервуар постоянного объема, не сообщающийся с атмосферой.
Рис. 1. Газгольдер с плавающим колоколом
Рис. 2. Газгольдер типа сообщающихся сосудов
При повышении давления сверх допустимого предела избыток ацетилена выпускают в атмосферу через предохранительный клапан. Генераторы этого типа изготовляют на рабочее давление до 15 000 мм вод. ст. Давление в газгольдере меняется пропорционально находящемуся в нем количеству ацетилена. Генераторы часто имеют автоматические устройства для поддержания более постоянного рабочего давления ацетилена.
Для питания сварочных горелок желательно иметь возможно более высокое давление ацетилена. Повышение давления улучшает работу сварочных инжекторных горелок, облегчает подачу ацетилена по трубопроводам, уменьшает колебания давления газа у горелки в процессе сварки. Ацетилен под давлением порядка 6000—10 000 мм вод. ст. позволяет работать безынжекторными горелками высокого давления, простыми по конструкции, надежными в работе, обеспечивающими максимальные устойчивость и постоянство сварочного пламени. Поэтому технологически для сварки ацетиленовый генератор тем лучше, чем выше давление производимого им ацетилена.
Достоинства и недостатки
Достоинства у ацетиленовой сварки весомые. Во-первых, вам не нужно использовать электричество, чтобы произвести сварку. К тому же, все оборудование можно перевозить на специальной тележке, и вы сможете варить на улице в труднодоступных местах. Во-вторых, вы можете просто поменять угол направления пламени, и температура ванны сразу же изменится. Так можно довольно удобно регулировать степень нагрева.

В-третьих, при должной сноровке вы можете избежать прожогов просто меняя расстояние от сварочной ванны до горелки. Но не стоит забывать и о недостатках. Нужно понимать, что такая сварка требует много времени и терпения, поэтому ее нельзя назвать производительной.
А такой вариант вряд ли подойдет для крупного предприятия с большим количеством выпускаемой продукции. Также учитывайте, что во время сварки нагревается не только сварочная ванна, но и вся прилегающая область металла, а это не очень хорошо для детали. Также такую работу не сможет выполнить сварщик низкой квалификации, обязательно нужен профессионал своего дела.
Где взять карбид?
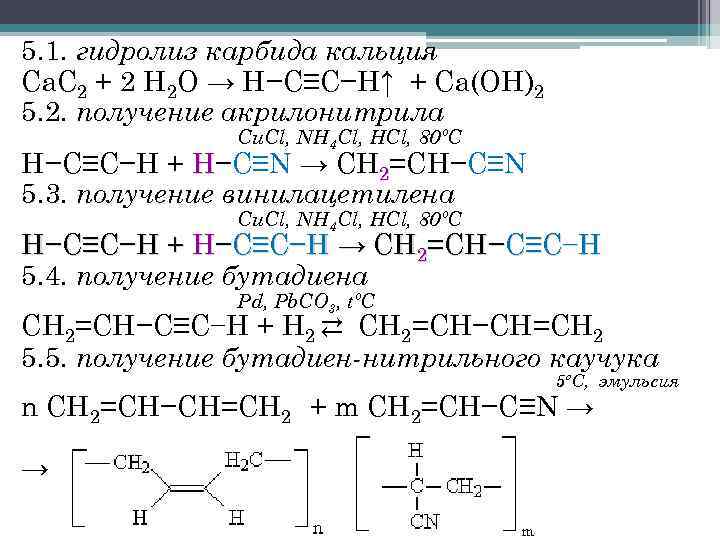
Поместите посуду над спиртовкой или газовой горелкой. Выпаривайте раствор на медленном огне до получения кристаллического нитрата кальция. Будьте осторожны при работе с кислотой. Работайте в перчатках и защитных очках. Используйте только достаточно разбавленную азотную кислоту, чтобы исключить слишком быстрое прохождение реакции. Храните нитрат кальция в герметично закрытых емкостях. Он очень гигроскопичен и быстро набирает влагу из воздуха. Ацетилен – самый простой представитель класса алкинов, имеет химическую формулу С2Н2. Бесцветный газ, горюч, в смеси с воздухом взрывоопасен. Благодаря наличию тройной связи в своей молекуле, весьма активен с химической точки зрения, легко вступает в реакции присоединения. При сгорании выделяет большое количество тепла, что может быть использовано, например, многим известная «ацетиленовая горелка». Как же его синтезировать?  При хранении ацетилена следует учитывать его особенности. Например, его нельзя держать в баллонах, имеющих бронзовый вентиль, поскольку газ реагирует с медью, входящей в состав бронзы, образуя чрезвычайно взрывоопасное вещество – ацетиленид меди. Самый старый, проверенный временем метод получения ацетилена – реакция карбида кальция с водой. Наверное, многие мальчишки в детстве развлекались, бросая кусочки карбида в лужу, тут же начиналось яростное шипение, карбид буквально «бурлил», исчезая на глазах, и в воздухе отчетливо пахло чем-то резким, «острым». Эта реакция протекает таким образом: СаС2 + 2Н2О = С2Н2 + Са(ОН)2 Для того чтобы она протекала не слишком бурно, можно использовать не простую воду, а насыщенный раствор хлорида натрия, например. Если этот опыт планируется показать на уроке химии, следует подобрать реакционную колбу подходящего размера. Если она будет слишком маленькой, то образующая при растворении карбида пена может быть «выброшена» давлением ацетилена в отводную трубку, и дальше – в приемный сосуд. В случае же с чересчур большой колбой, придется долго ждать, пока образующийся ацетилен не вытеснит весь воздух из прибора. Воду, а лучше насыщенный раствор хлорида натрия, следует добавлять в колбу с кусочками карбида медленно, по каплям, регулируя скорость реакции, не допуская, чтобы она протекала чересчур бурно. Используется ацетилен в самых разных областях. Например, как сырье для получения целого ряда химических веществ (уксусной кислоты, пластмасс, некоторых ароматических углеводородов, некоторых видов синтетического каучука, этилового спирта и т.д.). На его основе синтезируют некоторые очень сильные взрывчатые вещества, используемые в качестве инициаторов, т.е. для детонации. Повсеместно применяется при резке и сварке металлов, при получении яркого света в автономных светильниках. Электрическая дуга – явление очень яркое, поэтому используйте темные очки, берегите глаза. При приготовлении смеси не обязательно считать молярную массу, просто старайтесь брать кокс в избытке, дело в том, что в процессе лишний углерод выгорит на воздухе. Чем больше ток, тем лучше, но без фанатизма. Как получить карбид кальция
При хранении ацетилена следует учитывать его особенности. Например, его нельзя держать в баллонах, имеющих бронзовый вентиль, поскольку газ реагирует с медью, входящей в состав бронзы, образуя чрезвычайно взрывоопасное вещество – ацетиленид меди. Самый старый, проверенный временем метод получения ацетилена – реакция карбида кальция с водой. Наверное, многие мальчишки в детстве развлекались, бросая кусочки карбида в лужу, тут же начиналось яростное шипение, карбид буквально «бурлил», исчезая на глазах, и в воздухе отчетливо пахло чем-то резким, «острым». Эта реакция протекает таким образом: СаС2 + 2Н2О = С2Н2 + Са(ОН)2 Для того чтобы она протекала не слишком бурно, можно использовать не простую воду, а насыщенный раствор хлорида натрия, например. Если этот опыт планируется показать на уроке химии, следует подобрать реакционную колбу подходящего размера. Если она будет слишком маленькой, то образующая при растворении карбида пена может быть «выброшена» давлением ацетилена в отводную трубку, и дальше – в приемный сосуд. В случае же с чересчур большой колбой, придется долго ждать, пока образующийся ацетилен не вытеснит весь воздух из прибора. Воду, а лучше насыщенный раствор хлорида натрия, следует добавлять в колбу с кусочками карбида медленно, по каплям, регулируя скорость реакции, не допуская, чтобы она протекала чересчур бурно. Используется ацетилен в самых разных областях. Например, как сырье для получения целого ряда химических веществ (уксусной кислоты, пластмасс, некоторых ароматических углеводородов, некоторых видов синтетического каучука, этилового спирта и т.д.). На его основе синтезируют некоторые очень сильные взрывчатые вещества, используемые в качестве инициаторов, т.е. для детонации. Повсеместно применяется при резке и сварке металлов, при получении яркого света в автономных светильниках. Электрическая дуга – явление очень яркое, поэтому используйте темные очки, берегите глаза. При приготовлении смеси не обязательно считать молярную массу, просто старайтесь брать кокс в избытке, дело в том, что в процессе лишний углерод выгорит на воздухе. Чем больше ток, тем лучше, но без фанатизма. Как получить карбид кальция
КАРБИДЫ, профессиональные вредности
КАРБИДЫ, профессиональные вредности ,— соединения углерода с металлами и нек-рыми неметаллами, которые могут оказывать неблагоприятное действие на организм человека. Естественные К. обнаруживаются в составе глубинных пород земной коры, иногда в метеоритах. Получают К. гл. обр. нагреванием порошков металлов и углерода (уголь, сажа) в среде инертного или восстановительного газа. К. применяются в ядерной технике, космонавтике, электронике, в технике высоких температур, машиностроении, металлургии, а также для получения ацетилена (см. Ацетилен) и цианамида (см. Дефолианты).
По характеру взаимодействия с водой К. подразделяют на разлагаемые и неразлагаемые. К разлагаемым водой относят К. щелочных и щелочноземельных металлов (кальция, стронция, бария), а также магния, бериллия, алюминия, лантаноидов и актиноидов. К не разлагаемым водой относят ковалентные К. бора и кремния, а также К. d-переходных металлов IV — VIII групп периодической системы Д. И. Менделеева.
В производстве К. возможно выделение пыли исходных компонентов, готового продукта и газов (окиси углерода). Имеет место интенсивное тепловыделение.
Пыль разлагаемых водой К. (особенно CaC2) вызывает раздражение слизистой оболочки дыхательных путей, в особенности полости носа, а также слизистых оболочек глаза. Дополнительное токсическое действие обусловлено вдыханием ацетилена. При попадании на кожу, особенно влажную, пыль К. вызывает раздражение, изъязвления и воспалительную реакцию. При получении и применении К. кальция предусматривают мероприятия по предупреждению поступления в воздух пыли, ацетилена и других газов. Необходима защита кожи и слизистых оболочек при работе с разлагаемыми водой К.
В производстве изделий из К. используют технологию порошковой или плазменной металлургии. Обработку изделий из К. осуществляют абразивным, ультразвуковым или электроискровым способами. При дроблении К., взвешивании компонентов шихты, просеве, загрузке и выгрузке, упаковке, обработке образуется аэрозоль дезинтеграции. При обслуживании электродуговых печей регистрируется низкочастотный шум (см. Шум). При отливке расплавленных К. возможно выделение паров углеводородов и окиси углерода.
К., не разлагаемые водой, практически малотоксичны. Действие пыли К. на органы дыхания экспериментальных животных проявляется в виде нерезких фиброзных реакций, более выраженных при введении пыли карбида бора. В легочной ткани отмечается диффузное утолщение межальвеолярных перегородок, особенно вокруг очагов пылевых скоплений. В поздние сроки развивается перибронхиальный склероз и пневмосклероз (см.).
При сухой шлифовке и обтачивании изделий с использованием искусственных абразивов может развиться своеобразный доброкачественный пневмокониотический процесс — пневмокониоз шлифовальщиков (см. Пневмокониозы).
Наиболее целесообразно использовать для спекания изделий из К. печи, оборудованные механическими загрузочными устройствами и автоматическим контролем температурного режима, применение защитных приспособлений (теплоизоляция, экраны, завесы) от инфракрасного излучения. При периодических медосмотрах рекомендуется проводить рентгенографию легких, исследование функции внешнего дыхания.
Библиография
Брахнова И. Т. Токсичность порошков металлов и их соединений, Киев, 1971, библиогр.; Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1—2, Л., 1976; Профессиональные болезни, под ред. А. А. Летавета, М., 1973; Самсонов Г. В. и Косолапова Т. Я. Высокотемпературные карбиды, Киев, 1975.
Источник
Применение карбида кальция
Как ранее было отмечено, карбид кальция встречается в самых различных областях промышленности, зачастую поставляют для проведения промышленного синтеза. Свойства карбида кальция и реакция, протекающая при его соединении с различными веществами, определяют использование вещества в нижеприведенных случаях:
- Многие синтетически компоненты, входящих в состав современных материалов, производят на основе рассматриваемого компонента.
- Применяется для получения цианамида кальция. Подобный компонент используется для получения различных химических удобрений. Именно поэтому сырье применяется для регулирования скорости роста растений.
- Цианамид кальция также получают при соединении вещества с азотом.
- В некоторых случаях проводится восстановление металлов щелочной группы.
- Можно использовать рассматриваемое соединение в процессе газовой сварки.
При рассмотрении карбида кальция и области применения стоит учитывать, что подобное вещество чаще всего применяют для получения ацетилена. Подобный синтез карбида кальция разработал немецкий ученый. Среди особенностей подобного способа применения отметим следующие моменты:
- Ацетилен из карбида получают при оказании воздействия водой на используемое сырье.
- В результате прохождения химической реакции образуется требующийся газ, гашеная известь выпадает в осадок.
- Стоит учитывать, что при смешивании компонентов выделяется большое количество тепла. Поэтому работа должна проводится с учетом техники безопасности.
- В зависимости от вида применяемой технологии переработки сырья с 1 килограмма выходит около 290 литров газа.
- Скорость протекания процедуры зависит от чистоты применяемого сырья, температуры и количества воды.

Получение ацетилена из карбида кальция
Как показывает практика, при использовании чистого карбида на протекание химической реакции отводится около 20 литров волы на 1 килограмм сырья. Подобное количество воды требуется для того чтобы снизить температуру реакции, за счет чего обеспечиваются оптимальные условия для работы.
Карбид титана TiC
Карбид титана TiC представляет собой соединение светло-серого цвета с металлическим блеском. Он химически инертен при комнатной температуре: плохо растворяется в кислотах, их смесях и некоторых щелочах в холодном и нагретом состояниях.
При высоких температурах (выше 2500°С) начинает реагировать с азотом. При взаимодействии с водородом обезуглероживается. Кроме того, окисляется углекислым газом при температурах выше 1200°С. Температура активного окисления карбида титана составляет 1100…1200°С.
Область температурной устойчивости TiC достигает 3140°С, он высокостоек в расплавленных легкоплавких металлах и металлах типа меди, алюминия, латунях, чугунах и сталях. Степень черноты карбида титана равна 0,9 (при длине волны 0,655 мкм). Физические свойства карбида титана TiC
| Молекулярная масса | 59,9 |
| Тип решетки | Кубическая |
| Плотность, кг/м3 | 4930 |
| Температура плавления, °С | 3147±50 |
| Температура кипения, °С | 4305 |
| Твердость по шкале Мооса | 8-9 |
| Средний ТКЛР в интервале 20-2700°С, α·106, град-1 | 9,6 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | 33,7 |
| Удельная массовая теплоемкость при 25°С, Дж/(кг·град) | 842 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | 34…39 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 60 |
Можно ли тушить водой карбид кальция?
Calcium carbide является негорючим продуктом, но выделяющийся при его разложении ацетилен взрыво- и пожароопасен. Он легко воспламеняется даже при кратковременном контакте с воздухом и обладает способностью самовоспламеняться даже в чистом виде. Он также легко вступает в реакцию с солями меди, серебра и ртути с образованием нестойких взрывчатых ацетеленидов. Обладает наркотическим действием, обусловленным фосфористым водородом в его составе.
Реагент ни в коем случае не разрешается тушить водой! При попадании жидкости в емкости с веществом возможны взрывы. Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Ацетилен легче воздуха, поэтому возможно его накопление в высших точках слабовентилируемых помещений.
использовать
В просторечии карбид обычно приравнивается к карбиду кальция . В газогенераторе он реагирует с водой с образованием этина (обычное название: ацетилен), который используется для различных целей.
- В прошлом карбид кальция смешивался с водой в карбидных лампах , с которой он реагировал с образованием горючего этина ; этин был зажжен и горел ярким пламенем. Этот метод использовался, в частности, в шахтных светильниках при подземных горных выработках. Спелеологи по-прежнему отдают предпочтение карбидным лампам, потому что они дают особенно красивый свет, а пламя можно использовать для обозначения поверхностей сажей .
- Производство цианамида кальция
- Синтез этина, работа карбидных проявителей (сегодня актуально только в развивающихся странах)
- Для обессеривания чугуна и жидкой стали в сталелитейной промышленности.
- Примерно с 1900 года до 1930-х годов карбидные лампы, специально изготовленные для этой цели, также использовались в качестве велосипедных фонарей. Эти карбидные велосипедные фонари светят намного ярче, чем соответствующие масляные или свечные лампы.
- Образование этина используется для определения остаточной влажности образцов почвы или бетона . Здесь образец заполняется в стандартизированную стальную бутылку вместе с ампулой карбида кальция и четырьмя стальными шариками и герметизируется головкой манометра. Бутылку встряхивают, в результате чего образец дробится, а ампула с карбидом кальция разбивается. Давление газа, возникающее в результате реакции карбида кальция и влаги, можно считать на головке манометра и преобразовать в содержание влаги. Этот процесс известен как карбидный метод (CM) . Метод используется, например, после того, как стяжка была уложена, чтобы определить, можно ли уже укладывать верхнее покрытие.
- Карбид кальция используется в качестве активного ингредиента в репеллентах для отпугивания полевок и кротов . Газовая смесь, возникающая при контакте с почвенной влагой, отгоняет животных, не убивая их.
Карбидная стрельба
→ Основная статья : Твердосплавные заклепки
Если положить несколько кусочков карбида кальция в молочную банку и сбрызнуть их небольшим количеством воды, в объеме, закрытом крышкой или футбольным мячом , образуется взрывоопасная газовая смесь этина и кислорода . Затем газовая смесь воспламеняется через предварительно просверленное отверстие в земле. Взрыв может отбросить крышку или футбольный мяч на расстояние до 70 м. В отличие от картофельной пушки , направление менее предсказуемо. Традиция стрельбы из карбида в основном культивируется в Нидерландах, а также в некоторых частях северо-западной Германии и северной Баварии молодыми людьми на свадьбах, в канун Нового года и Новый год. В Верхней Лужице это называют пасхальной стрельбой . В восточно-фризской области Германии и восточной части Нидерландов стрельба из карбида является неотъемлемой частью традиционных празднований Нового года. В Каринтии (Австрия) стрельба из карбида проводится по пасхальному обычаю – от благословения еды в Великую субботу до празднования воскресения утром в пасхальное воскресенье.
Карбидная рыбалка
Во время голода после Второй мировой войны многие люди использовали тот же принцип , чтобы иметь возможность быстро и вычистить много рыбы, взорвав твердосплавную банку, которая в то время была легко доступна в рыбных водах , несмотря на запрет динамитная рыбалка .
Топливный газ для сварки
Карбид широко использовался примерно до 1960 года для получения высокоэнергетического топливного газа ацетилена (этина) в проявителях карбида при низком давлении, который – в сочетании с кислородом – уникально хорош для сварки ( сварка плавлением газа ) стали. благодаря своей особенно высокой температуре пламени ( железные сплавы ), например, подходит для производства трубопроводов в секторе газа / воды / отопления. Большие газовые генераторы постоянно устанавливались в мастерских, а меньшие – на строительных площадках. Для этого карбид нужно было хранить в жестяных банках, например, защищенных от попадания водяного пара.
Этот процесс производства ацетилена на месте был необходим, потому что ацетилен, если его сжать для хранения в обычном газовом баллоне, разложился бы с серьезными последствиями и в то же время выделил бы тепло.
Только с техническим развитием ацетиленового баллона , в котором этот газ может безопасно храниться в растворенном виде в растворителе под средним или высоким давлением, подача газа может быть переключена на баллоны и упрощена для пользователя. В течение долгого времени бутылки с ацетиленом содержали канцерогенный асбест, они все еще тяжелые и чувствительны к ударам и нагреванию из-за растворителей и пористой подложки.
Свойства
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
Представленная выше реакция является экзотермической.
Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Разновидности карбидов
Различают несколько разновидностей карбидов в зависимости от конфигурации кристаллической решетки. Тип решетки определяет ряд физико-химических свойства материала, что нужно учитывать при их применении. Рассмотрим основные разновидности кристаллических решеток карбидов:
- Материалы с ковалентной решеткой. Вещества с таким способом связи возможны только в том случае, если в качестве второго элемента выступает бром или кремний. На атомарном уровне соединение образуется за счет sp, sp-2 или sp-3 гибридизации. В веществе атомарный металл заменяет собой углерод, что позволяет формировать прочное устойчивое вещество, которое устойчиво к механическим ударам, высоким температурам, химическим веществам. С точки зрения электропроводности вещество является полупроводником (хотя использование карбидов в качестве полупроводниковых элементов невыгодно с практической точки зрения).
- Металлоподобные материалы. В эту группу входят соединения, у которых металлических элемент является железом, кобальтом, никелем либо относится к переходной группе (IV-VII). У таких карбидных соединений металлические атомы располагаются не на месте атомов углерода, а в различных пустотах кристаллических решеток (поэтому часто такие вещества называют карбидами внедрения). Такое необычное расположение делает вещество устойчивым, крепким, надежным, оно не будет разрушаться под воздействием высоких температур или при воздействии химически активных веществ (кислоты, щелочи, соли и другие).
- Материалы с ионной связью. В эту группу входит множество карбидов, у которых в качестве металлического элемента выступает алюминий, редкоземельные металлы либо элементы I или II группы периодической таблицы. По химической структуре вещества похожи на соединения с ковалентной решеткой с той лишь разницей, что здесь металлы обычно теряют один или несколько электронов на внешнем уровне, что приводит к образованию веществ-ионов. По химико-физическим свойствам ионные карбиды аналогичны стандартным соединениям — отличная прочность, высокая температура плавления. Единственное крупное отличие — вещества активно взаимодействуют с кислотами (обычно с образованием металла или подобных веществ).

Карбид: что это такое. Свойства, производство, применение
instrument.guru > Металлообработка > Карбид: что это такое. Свойства, производство, применение
Карбиды металлов — это соединения, которые не являются природными, получают их только искусственным путем.
Первое упоминание о создании этого вещества относится к началу 19 века, его синтезировал англичанин Деви в своей лаборатории. Позже были созданы и другие соединения.
В детстве многие любили взрывать это вещество, но далеко не все понимают, что же представляет из себя это соединение.
- Состав и виды карбидов
- Свойства
- Производство карбида
- Применение в промышленности
- Хранение и транспортировка
- Стоимость
Хранение и транспортировка
Поскольку карбид при вступлении в реакцию с влагой приводит к выделению большого количества тепла и взрывоопасного газа ацетилена, хранят данное вещество в герметичных баках или барабанах
Работа с такими баками требует особой осторожности
Газ ацетилен легче воздуха и способен самовоспламеняться, при этом обладает наркотическим действием.
При вскрытии барабанов с карбидом используют специальный инструмент, исключающий возникновение искр, а при попадании вещества на кожу требуется немедленно промыть водой пораженный участок и смазать жирным кремом.
Помещения хранения должны хорошо проветриваться, а содержание других веществ по соседству — запрещено. Это может привести к опасным реакциям. Неправильное хранение может как взорвать карбид, так и привести его в негодное состояние.
Срок хранения доходит всего до полугода.
Перевозка осуществляется только крытым транспортом. Воздушная доставка запрещена.
Стоимость
А вот, карбид вольфрама обойдется в 1400 рублей за кило. Причем, может быть установлен минимальный вес покупки, например, от 10 кг. Карбид бора будет стоить еще дороже — от 2000 рублей, причем фасовка начинается от 35 килограмм.
Стоимость же соединений с гафнием или молибденом оговаривается с поставщиком отдельно.
Заключение
Подведем итоги. Карбиды металлов — соединения, в состав которых входит углерод и какой-либо дополнительный металл. Это может быть железо, хром, цирконий, вольфрам и другие. Соединение может образовывать сложную прочную кристаллическую решетку (ковалентную, металлическую, ионную). Карбиды из-за особенностей своего строения отличаются высокой прочностью, устойчивостью к механической деформации, химической инертностью. Вещества обычно не вступают в реакцию с кислотами, щелочами, солями, атмосферными газами (кислород, азот, углекислый газ).
Из карбидов делают абразивные или шлифовальные инструменты, поскольку они не деформируются, не портятся со временем, могут деформировать другие прочные соединения. Из них делают электроды для сварочных инструментов, термоустойчивые стержни, элементы электрических инструментов. Некоторые виды карбидов могут проявлять необычные свойства. Скажем, карбид золота взрывается при легком контакте, а карбид кальция может вступать в реакцию с водой при комнатной температуре с образованием ацетилена.
- Статья на Википедии
- Самсонов Г. В., Косолапова Т. Я., Домасевич Л. Т. Свойства, методы получения и области применения тугоплавких карбидов и сплавов на их основе. Киев, 1974
- Gusev A. I., Rempel A. A. Nanocrystalline Materials. — Cambridge: Cambridge International Science Publishing, 2004.
- Вальков Ф. А. Неорганическая химия, учебник для педагогических вузов. — М.: Государственное учебно-педагогическое издательство, 1963.