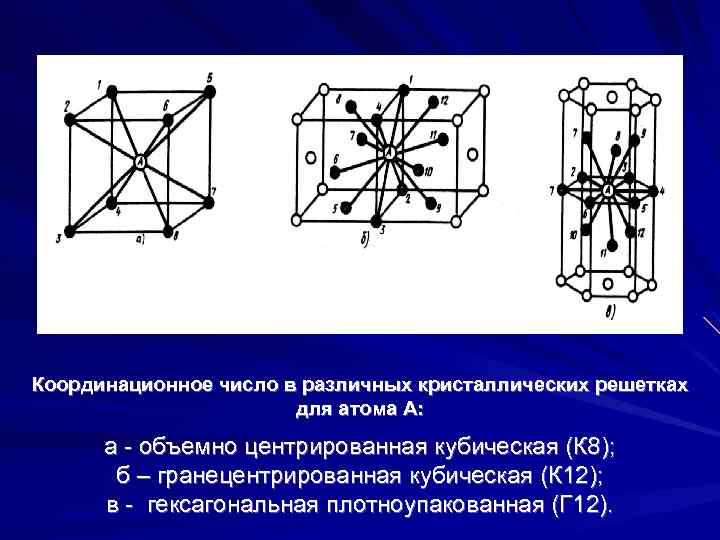
З. Гексагональная плотноупакованная решетка (ГПУ)
Рис.1.5
В гексагональной плотноупакованной решетке (рис.1.5) атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Ячейка ГПУ решетки содержит 17 атомов.
Гексагональную кристаллическую решетку имеют магний, кадмий, цинк и другие металлы.
Некоторые металлы могут изменять тип кристаллической решетки при изменении температуры (при нагреве, либо охлаждении). Такие металлы называются полиморфными.
Явление полиморфизма – изменение типа кристаллической решетки при изменении температуры.
Реальное строение металлов и сплавов
Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Таких кристаллов в природе практически не существует. Их можно создать только в лабораторных условиях (их называют металлические усы, т.к. их толщина соответствует нескольким межатомным расстояниям).
В реальных кристаллах всегдаприсутствуют дефекты кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материалов.
Различают два вида дефектов кристаллического строения: точечные и линейные.
Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров.
К точечным дефектам относятся :
— вакансии ( свободные места в узлах кристаллической решетки (рис.1.6);
— атомы внедрения и замещения (примесные атомы, которые могут находиться и в узлах решетки, и в междоузлии, рис.1.7 а, б)
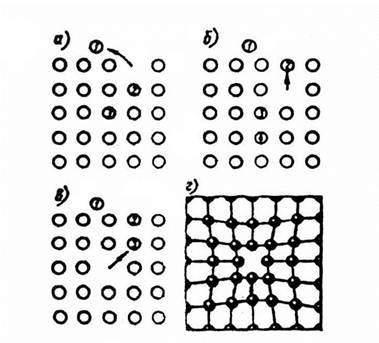
Рис.1.6. Вакансии
Атомы совершают колебательные движения возле узлов решетки. Под воздействием внешних воздействий (например, температуры) отдельные атомы приобретают энергию, значительно большую, чем средняя энергия соседних атомов в решетке. Эти атомы могут перемещаться из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находились такие атомы, называется вакансией (рис.1.6). На это место перемещается один из соседних атомов и т.д. Таким образом, вакансия перемещается вглубь кристалла.
При комнатной температуре концентрация вакансий сравнительно невелика и составляет около 1 на 1018 атомов, но количество вакансий в кристаллической решетке резко возрастает при нагреве и может достигать огромных величин. Так, например, в решетке некоторых металлов в 1 см3 количество вакансий может достигать 1013.
К точечным дефектам относят также атомы, внедренные в междоузлие кристаллической решетки (рис.1.7 а) и замещенные атомы, когда место атома основного металла замещается в кристаллической решетке атомом другого элемента (рис.1.7 б).
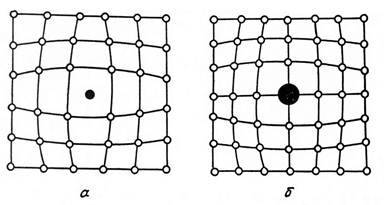
Рис. 1.7. Примесные атомы внедрения (а) и замещения (б).
Точечные дефекты приводят к локальным искажениям в кристаллической решетке и локальным изменениям межатомных связей. С увеличением количества точечных дефектов может возрастать сопротивление кристаллической решетки дальнейшему смещению атомов.
С другой стороны, присутствие вакансий в решетке объясняет возможность такого физического процесса, как диффузия.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.

Смотреть галерею
Пустоты в элементарной ячейке
Визуализация кубической элементарной ячейки алмаза: 1. Компоненты элементарной ячейки, 2. Одна элементарная ячейка, 3. Решетка из 3 x 3 x 3 элементарных ячеек.
Простая кубическая элементарная ячейка имеет одну кубическую пустоту в центре.
Объемно-центрированная кубическая элементарная ячейка имеет шесть октаэдрических пустот, расположенных в центре каждой грани элементарной ячейки, и двенадцать дополнительных, расположенных в середине каждого края той же ячейки, в общей сложности шесть октаэдрических пустот. Кроме того, есть 24 тетраэдрических пустоты, расположенных на квадратном расстоянии вокруг каждой октаэдрической пустоты, в общей сложности двенадцать чистых тетраэдрических пустот. Эти тетраэдрические пустоты не являются локальными максимумами и технически не являются пустотами, но иногда они появляются в многоатомных элементарных ячейках.
Гранецентрированная кубическая элементарная ячейка имеет восемь тетраэдрических пустот, расположенных на полпути между каждым углом и центром элементарной ячейки, всего восемь чистых тетраэдрических пустот. Кроме того, имеется двенадцать октаэдрических пустот, расположенных в средних точках краев элементарной ячейки, а также одно октаэдрическое отверстие в самом центре ячейки, всего четыре чистых октаэдрических пустот.
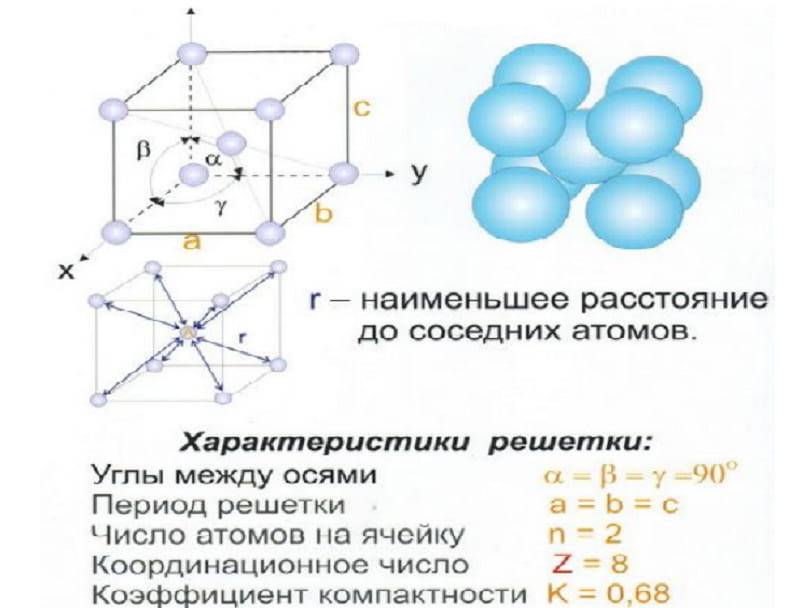
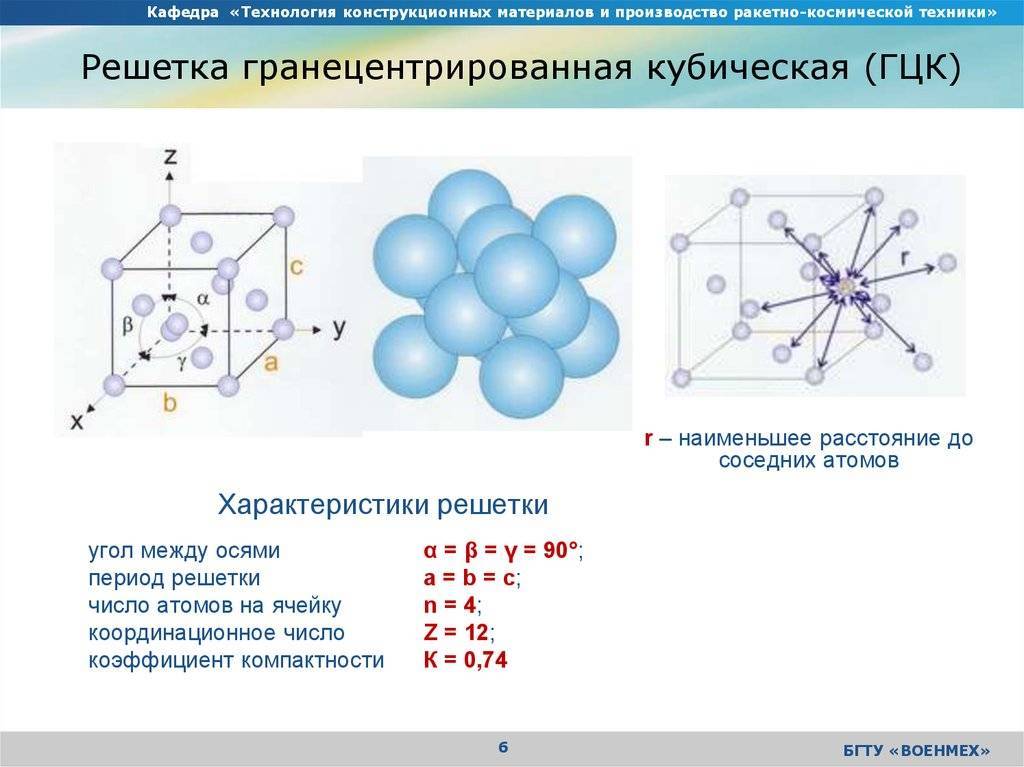
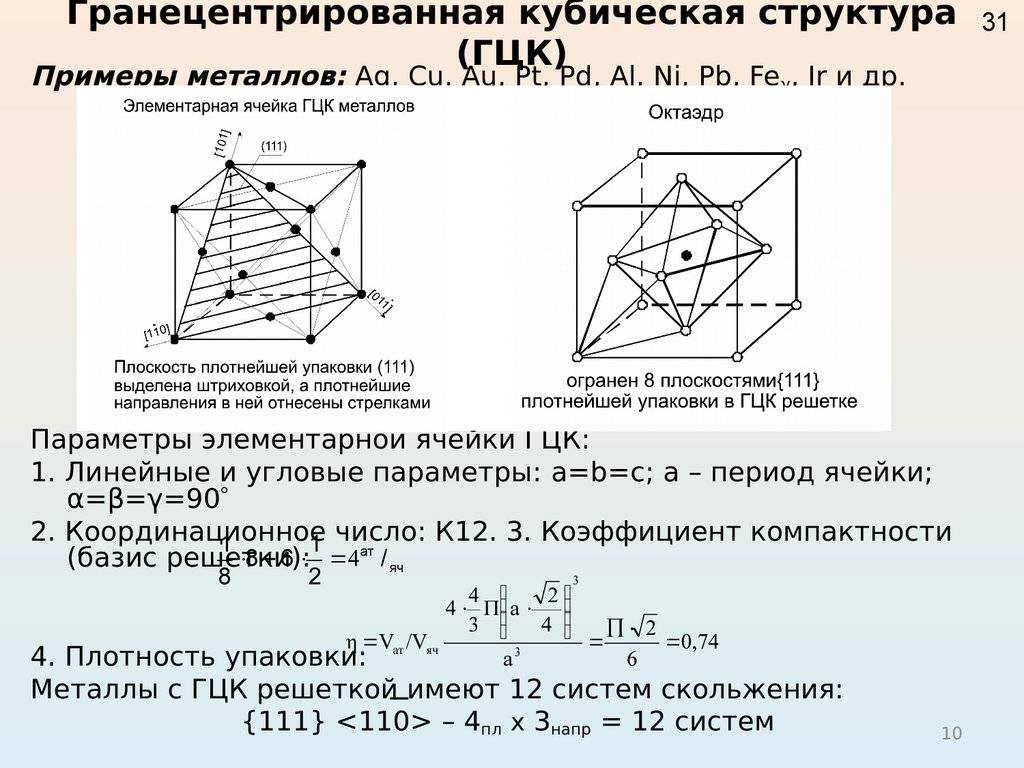
Одной из важных характеристик кристаллической структуры является фактор упаковки атомов . Это рассчитывается исходя из предположения, что все атомы являются идентичными сферами, с радиусом, достаточно большим, чтобы каждая сфера упиралась в следующую. Фактор упаковки атомов – это доля пространства, заполненного этими сферами.
Предполагая, один атом за решетку точки, в примитивной кубической решетке с длиной стороны кубы а, радиус шара будет 2 и атомный фактор упаковки оказывается около 0,524 (что является довольно низким). Точно так же в ОЦК решетке фактор упаковки атомов составляет 0,680, а в ГЦК – 0,740. Значение ГЦК является наивысшим теоретически возможным значением для любой решетки, хотя есть и другие решетки, которые также достигают того же значения, например гексагональная плотноупакованная ( ГПУ ) и одна версия тетраэдрической ОЦК .
Как правило, поскольку атомы в твердом теле притягиваются друг к другу, более плотно упакованные атомы имеют тенденцию быть более распространенными. (Хотя могут иметь место неплотно упакованные структуры, например, если орбитальная гибридизация требует определенных валентных углов .) Соответственно, примитивная кубическая структура с особенно низким коэффициентом упаковки атомов встречается редко в природе, но встречается в полонии . ОЦК и ГЦК, с их более высокой плотностью, оба довольно широко распространены в природе. Примеры ОЦК включают железо, хром, вольфрам и ниобий . Примеры ГЦК включают алюминий, медь, золото и серебро .
Примитивная ячейка
Элементарная ячейка называется примитивной, если ее частицы находятся только в вершинах решетки и отсутствуют в других местах. Ее объем является минимальным по сравнению с другими типами. На практике она оказывается часто низкосимметричной (примером может служить ячейка Вигнера-Зейтца).
У не примитивных ячеек атом в центре объема делит их на 2 или на 4 одинаковые части. В гранецентрированной структуре происходит разделение на 8 частей. В металлографии пользуются понятием элементарной, а не примитивной ячейки, так как симметрия первой позволяет более полноценно описать кристаллическую структуру материала.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Смотреть галерею
Атомные связи в неметаллах
Физические и химические свойства кристаллических неметаллов зависят от того, чем образована их кристаллическая решетка — атомами или молекулами, и их взаимодействием. Атомные или немолекулярные связи очень прочные, молекулярные — слабые.
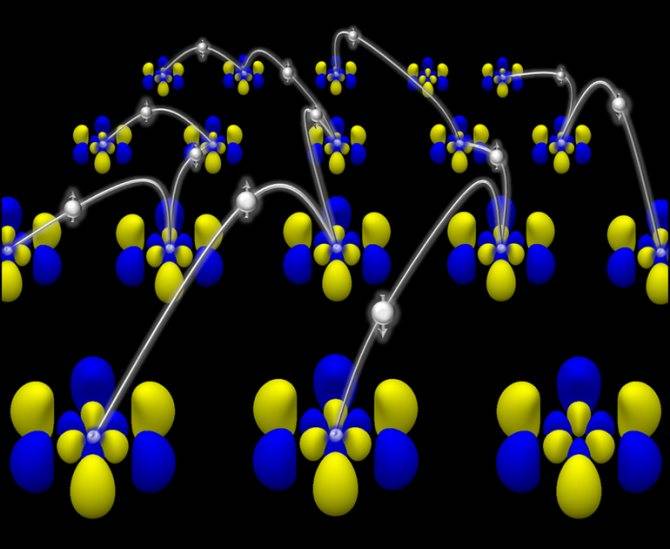
Между соседними атомами образуются совместные электронные пары, при этом каждый из них остается устойчивым элементом. Связь, созданная в таких парах, называется ковалентной (или прочной). Когда взаимодействуют атомы с одинаковой электроотрицательностью, то расположение электронной пары получается симметричным относительно двух атомов и называется ковалентной неполярной связью.
У веществ, состоящих из разных неметаллов, связь образовывается из атомов с разной электроотрицательностью, в результате чего общая электронная пара смещается к более отрицательному элементу. Получается ковалентная полярная связь.
Соединения с ковалентными связями бывают двух типов — молекулярными и атомными.
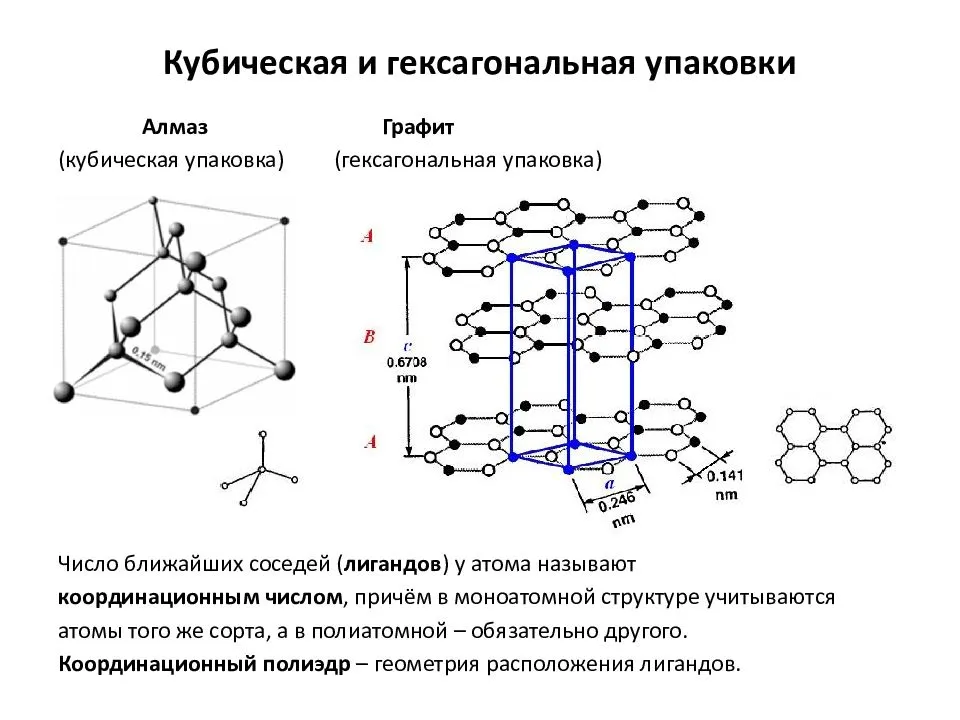
Структуры, в узлах которых размещаются атомы, соединенные ковалентными связями, называются атомными кристаллическими решетками. Если связь ковалентная неполярная, то в ее формировании участвуют атомы одного химического вещества. Такую структуру имеют кремний Si, бор B, германий Ge, кристаллические видоизменения углерода C. Геометрическое строение решетки кристалла имеет соответствие с его свойствами.
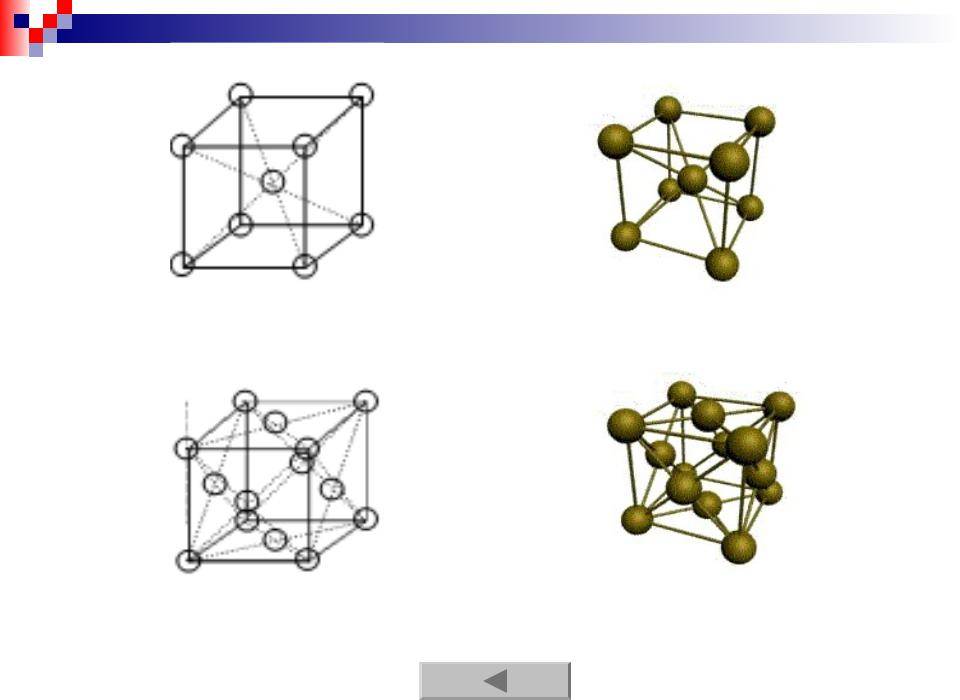
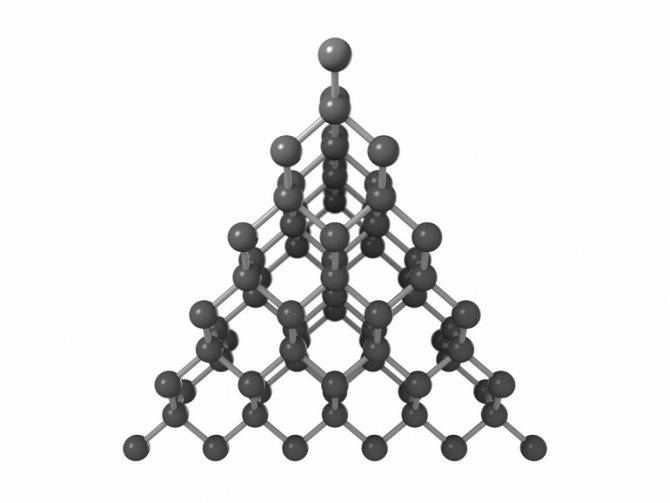
Например, две модификации углерода: алмаз и графит. В кубической структуре алмаза атомы расположены по одному в вершинах, по центру каждой грани, и четыре внутри самого куба. Это строение дает самую плотную упаковку атомов, а ковалентные связи между ними делает очень прочными. Поэтому алмаз является самым твердым материалом в мире. Другие свойства: теплопроводность низкая, электрический ток не проводит.

У графита гексагональная слоистая решетка, которая делает его мягким. Температура плавления очень высокая (4 тыс. градусов Цельсия), обладает электропроводностью, его называют полуметаллом и используют при производстве электродов.
При биполярной ковалентной связи атомная кристаллическая решетка обычно сформирована атомами разных химических элементов. Такое строение имеют муассанит, состоящий из кремния Si и углерода C, и диоксид кремния SiO2 в разных модификациях:
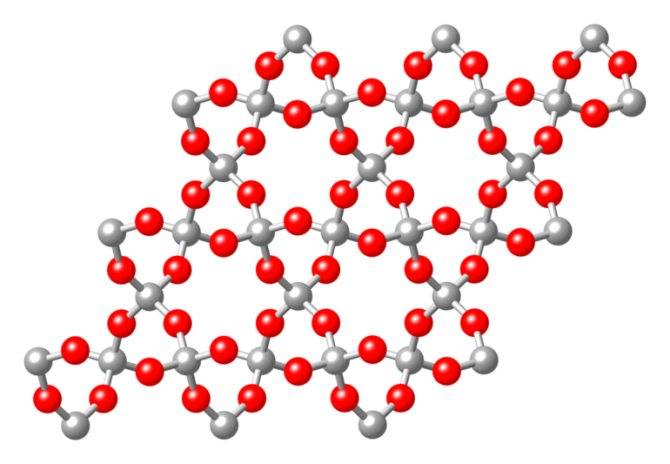
- кварцевый песок;
- лютецит;
- опал;
- халцедон;
- хрусталь;
- кремнезем.
Основные свойства: нерастворимость, прочность, твердость, высокие температуры плавления и кипения.
Компактность
Компактности или плотность, то есть доля пространства, занимаемые атомы, из граней кубических сеток является:
противзнак равноVолтыме опротивпротивтыпе´Полный объемзнак равно4×Vвтомев3знак равно4×(43⋅πр3)(4р2)3знак равноπ26≃,74{\ displaystyle c = {\ frac {\ mathrm {Объем ~ занято {\ sharp {e}}}} {\ text {Общий объем}}} = {\ frac {4 \ times V_ {atom}} {a ^ { 3}}} = {\ frac {4 \ times ({\ frac {4} {3}} \ cdot \ pi R ^ {3})} {\ left ({\ frac {4R} {\ sqrt {2}) }} \ right) ^ {3}}} = {\ frac {\ pi {\ sqrt {2}}} {6}} \ simeq 0.74}
Это максимально возможная плотность, также достигаемая компактной гексагональной сеткой (см . Гипотезу Кеплера ).
Произвольный набор атомов
Тень обратной решетки интенсивности граненого углеродного пентакона, состоящего из 118 атомов, загорается красным при дифракции при пересечении сферы Эвальда.
Один путь к обратной решетке произвольного набора атомов происходит от идеи рассеянных волн в пределах Фраунгофера (дальнего расстояния или задней фокальной плоскости линзы) как суммы амплитуд в стиле Гюйгенса от всех точек рассеяния (в этот случай от каждого отдельного атома). Эта сумма обозначается комплексной амплитудой F в приведенном ниже уравнении, потому что это также преобразование Фурье (как функция пространственной частоты или обратного расстояния) эффективного потенциала рассеяния в прямом пространстве:
- Fг→знак равно∑jзнак равно1Nжjг→е2πяг→⋅р→j.{\ Displaystyle F = \ sum _ {j = 1} ^ {N} f_ {j} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {j}}.}
Здесь g = q / (2π) – вектор рассеяния q в единицах кристаллографа, N – число атомов, f j – атомный коэффициент рассеяния для атома j и вектор рассеяния g , а r j – положение вектора атом j
Обратите внимание, что фаза Фурье зависит от выбора начала координат.. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
- Fчасkлзнак равно∑jзнак равно1мжjгчасkле2πя(частыj+kvj+лшj){\ displaystyle F_ {hkl} = \ sum _ {j = 1} ^ {m} f_ {j} \ left e ^ {2 \ pi i \ left (hu_ {j} + kv_ {j} + lw_ {j} \ right)}}
когда j = 1, m атомов внутри элементарной ячейки, дробные индексы решетки которых равны соответственно {u j , v j , w j }. Конечно, чтобы учесть эффекты, связанные с конечным размером кристалла, вместо этого следует использовать свертку формы для каждой точки или приведенное выше уравнение для конечной решетки.
Независимо от того, является ли массив атомов конечным или бесконечным, можно также представить себе “обратную решетку интенсивности” I [ g ], которая связана с решеткой амплитуд F через обычное соотношение I = F * F, где F * – комплексное сопряжение F Поскольку преобразование Фурье обратимо, конечно, этот акт преобразования в интенсивность отбрасывает «всю информацию, кроме 2-го момента» (то есть фазы). Таким образом, для случая произвольного набора атомов обратная решетка интенсивности имеет вид:
- яг→знак равно∑jзнак равно1N∑kзнак равно1Nжjг→жkг→е2πяг→⋅р→jk.{\ displaystyle I = \ sum _ {j = 1} ^ {N} \ sum _ {k = 1} ^ {N} f_ {j} \ left f_ {k} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {jk}} .}
Здесь r jk – векторное расстояние между атомом j и атомом k. Это также можно использовать для прогнозирования влияния формы нанокристаллита и тонких изменений ориентации луча на обнаруженные дифракционные пики, даже если в некоторых направлениях толщина кластера составляет всего один атом. С другой стороны, расчеты рассеяния с использованием обратной решетки в основном учитывают падающую плоскую волну. Таким образом, после первого взгляда на эффекты обратной решетки (кинематического рассеяния), уширение луча и эффекты многократного рассеяния (т.е. динамические ) также могут быть важны для рассмотрения.
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Кристаллическое строение металлов. Типы кристаллических решеток
Когда металл образует твердую структуру, то все его атомы стремятся занять такие положения в пространстве относительно друг друга, чтобы они соответствовали минимуму потенциальной энергии. Этому минимуму соответствует кристаллическая решетка.
Читать также: Как правильно установить автомагнитолу
Под кристаллической решеткой понимают такую пространственную атомную структуру, которая может быть получена, если известны координаты ограниченного числа ее атомов и вектора их трансляции в пространстве. Указанное число атомов называется базисом решетки, а их положения образуют так называемую элементарную ячейку.
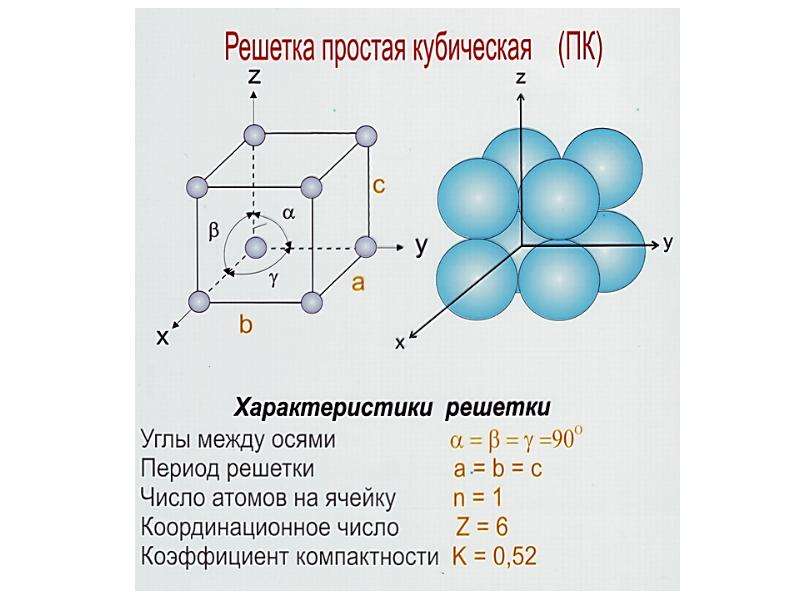
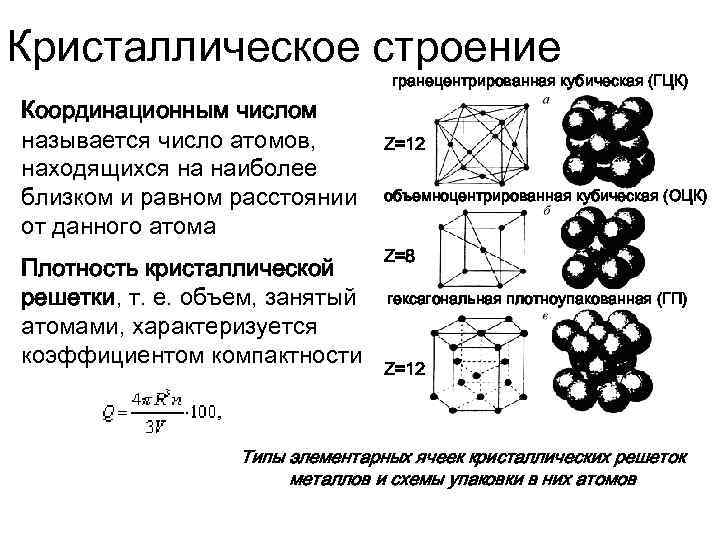
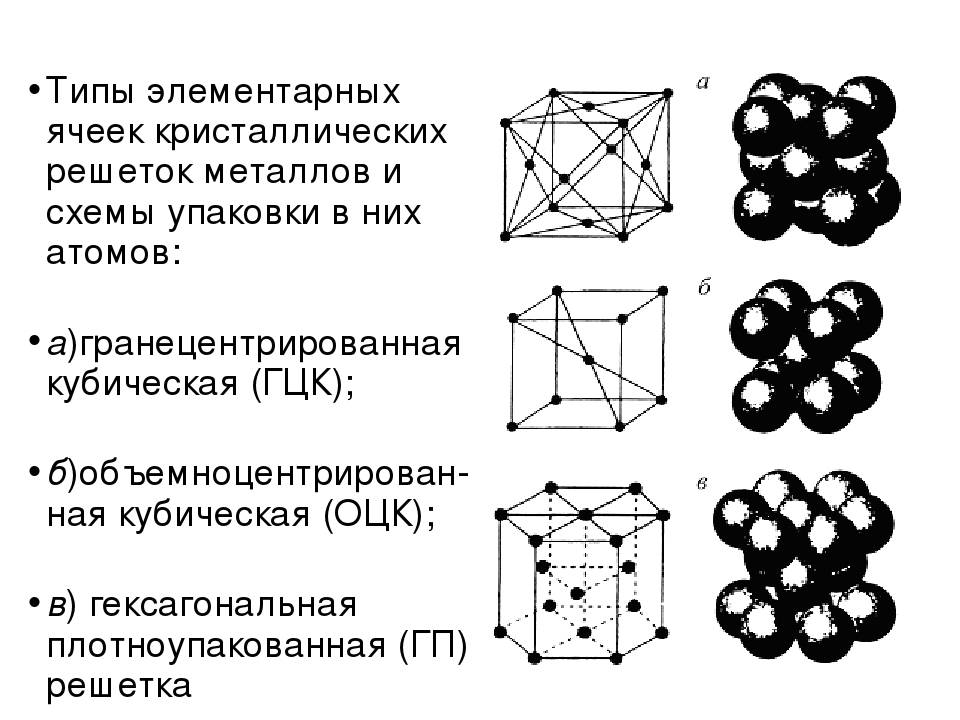
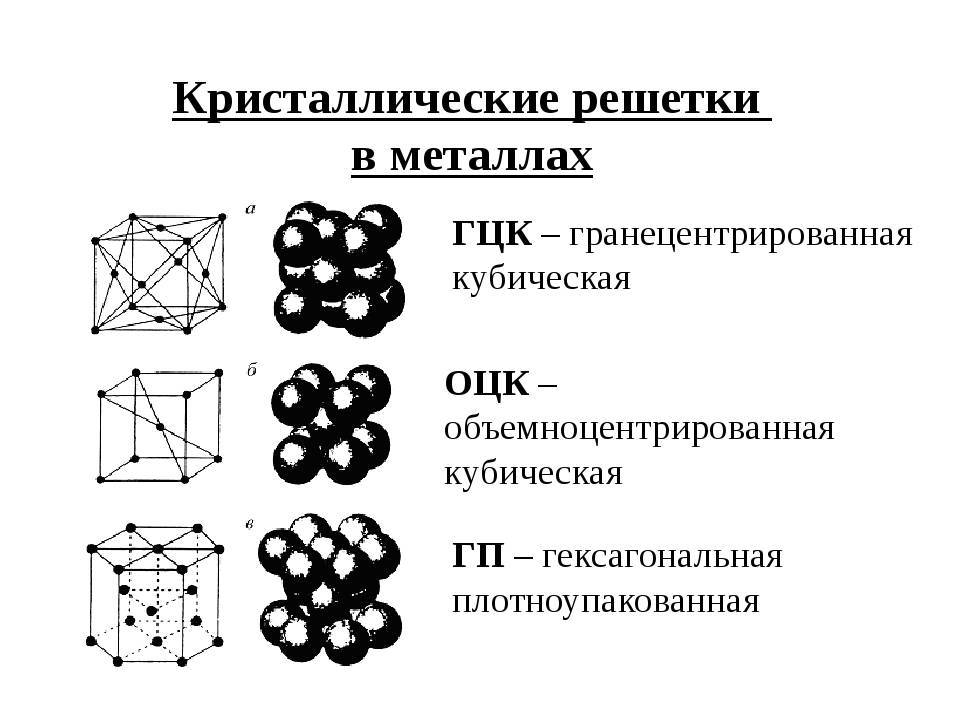
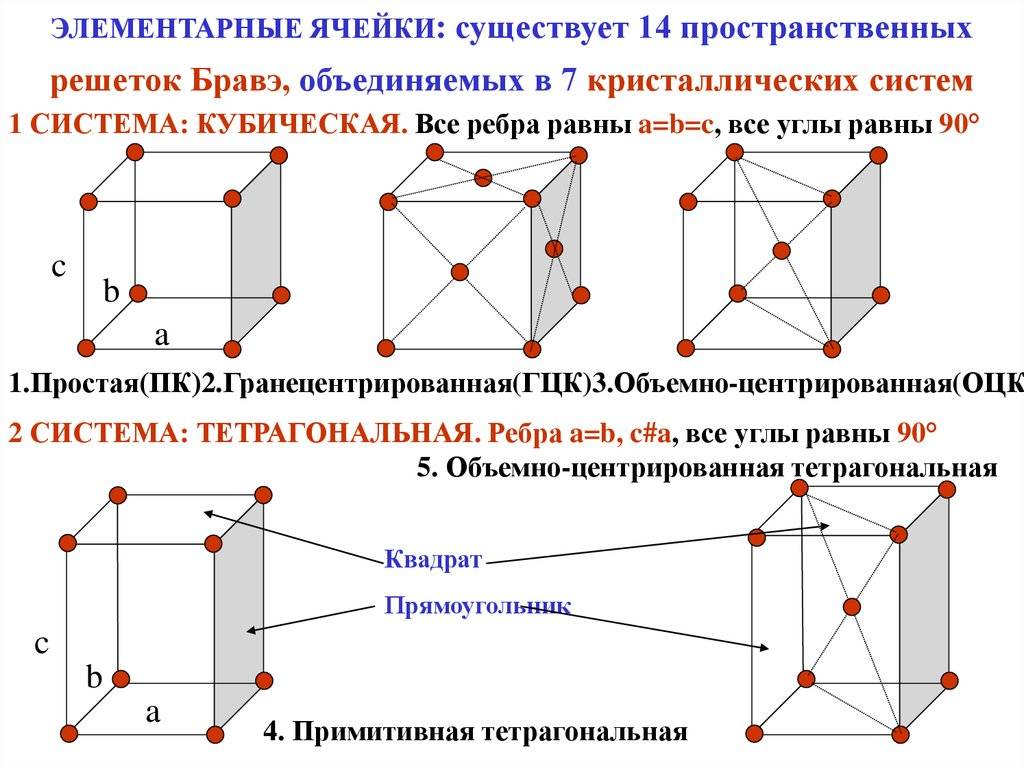
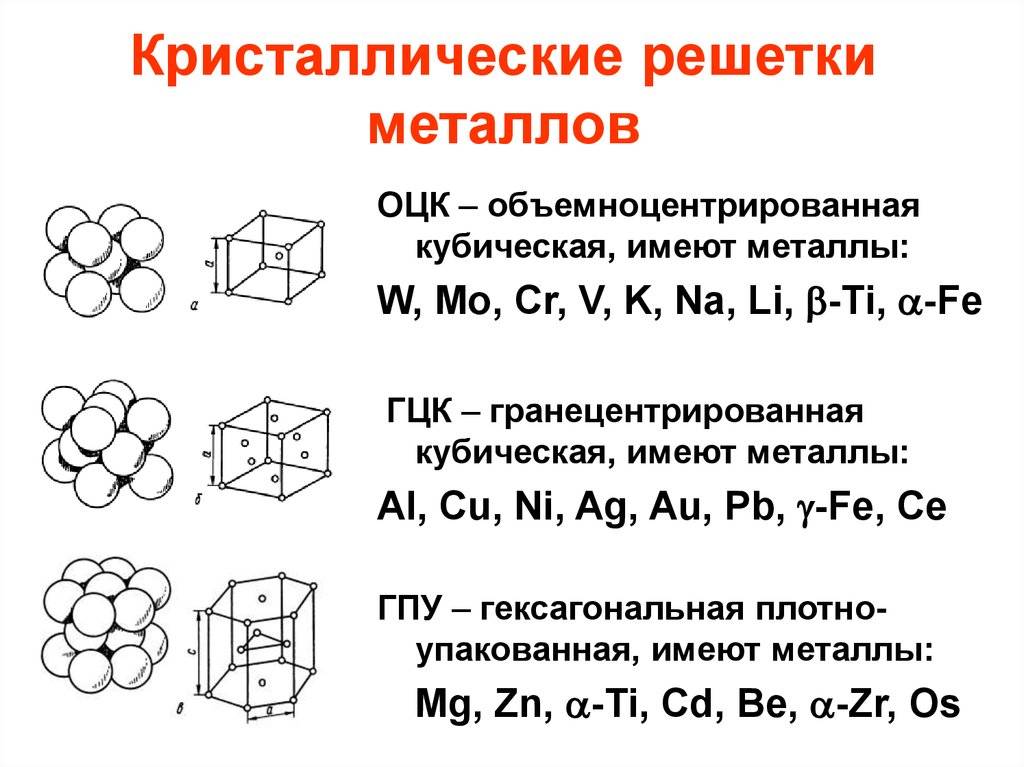
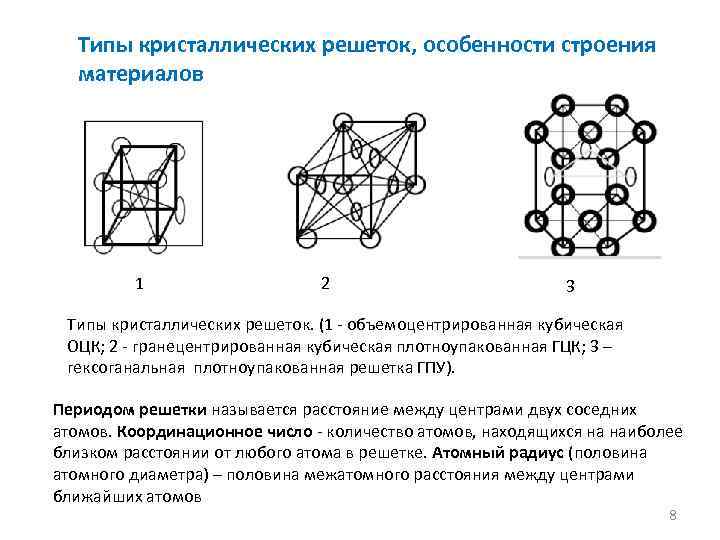
Все металлы кристаллизуются в трех основных типах решеток:
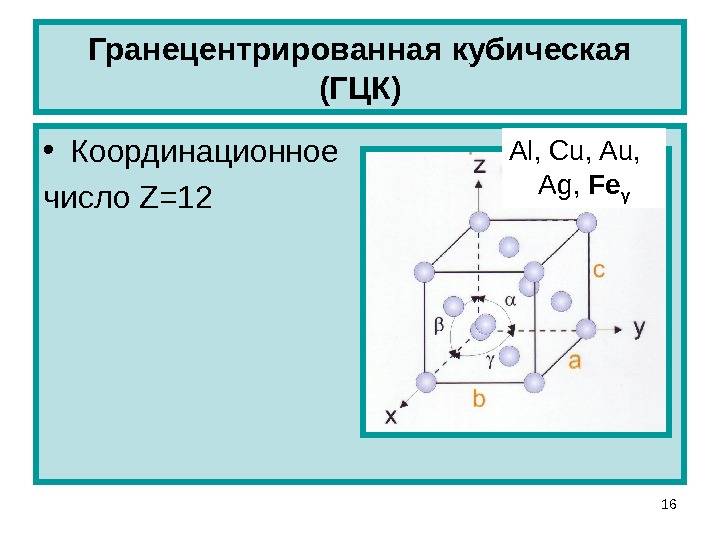
- гранецентрированная кубическая (ГЦК);
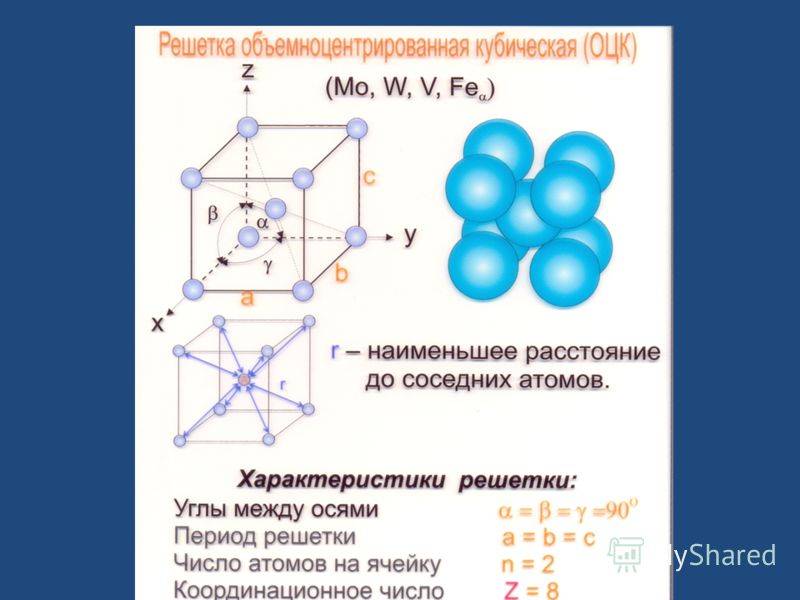
- объемно-центрированная кубическая (ОЦК);
- гексагональная плотноупакованная (ГПУ).
Благодаря кристаллическому строению металлы обладают такими свойствами, как пластичностью, упругостью и металлическим блеском.
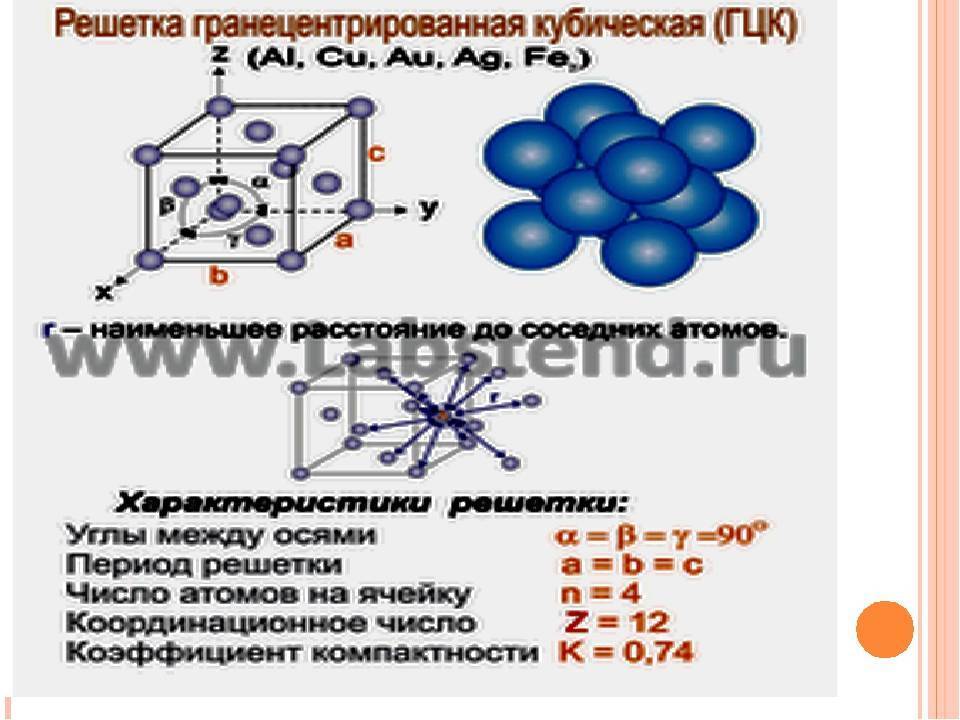
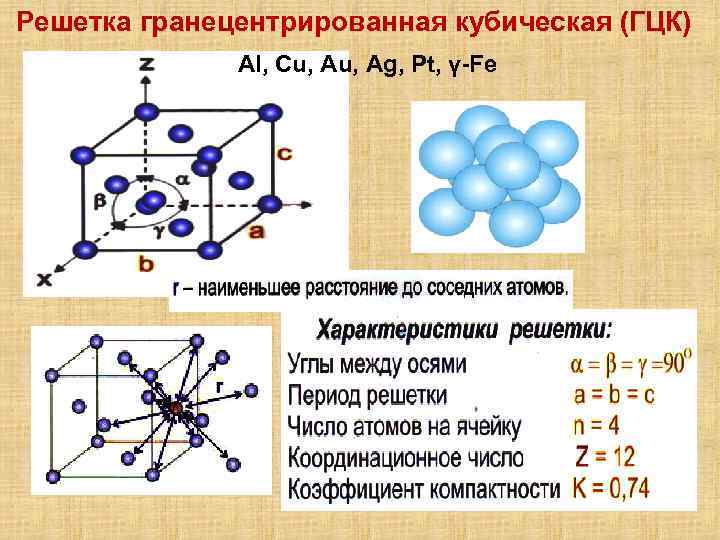
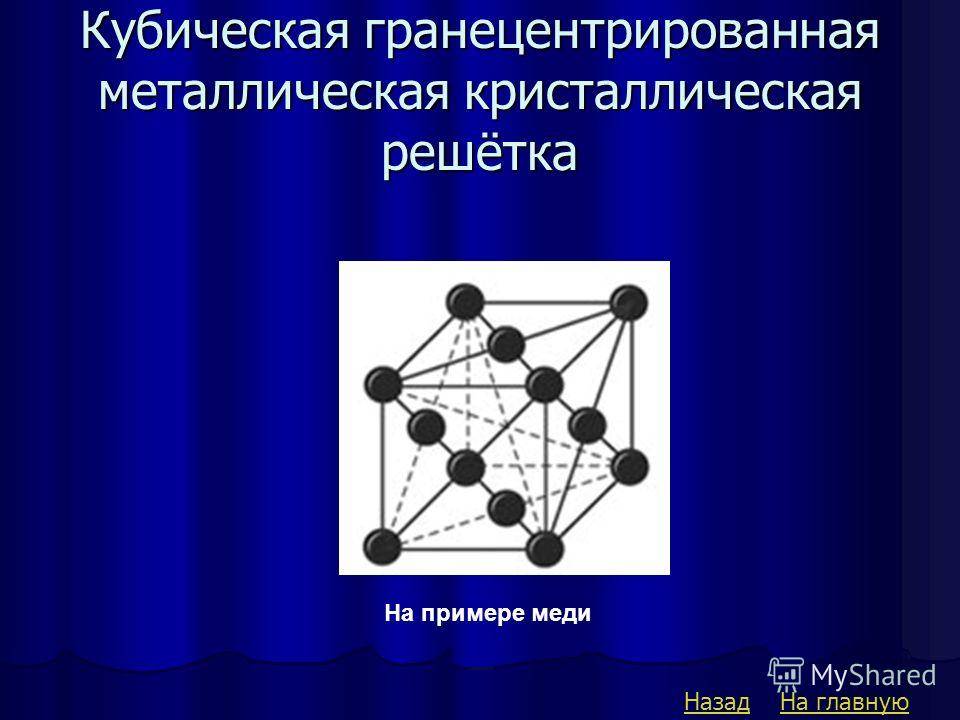
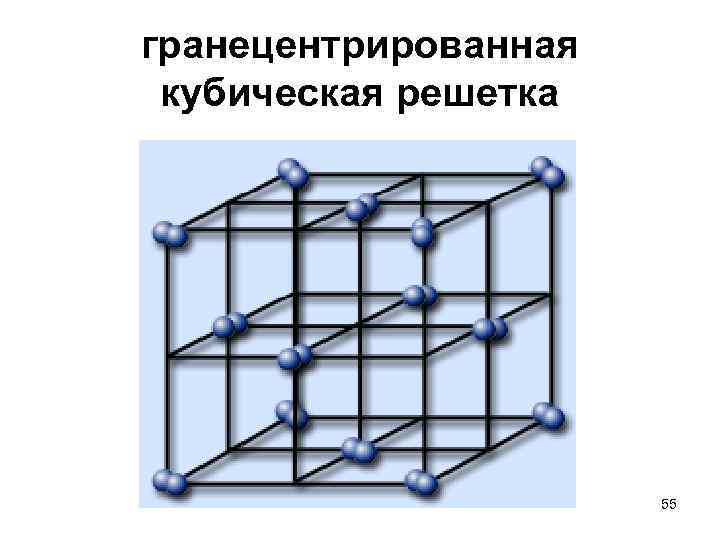
Кубическая гранецентрированная решетка
Алюминий является трехвалентным растворителем и имеет кубическую гранецентрированную решетку. Первая зона Брил-люэна у алюминия может вместить только два электрона на атом, и поэтому она должна перекрываться поверхностью Ферми. Однако, как показал Харрисон , степень перекрытия может быть различной, если исходить из сферической формы поверхности Ферми, характерной для свободных электронов. Наличие такого перекрытия у чистого алюминия, очевидно, весьма незначительно отражается на периоде решетки при образовании сплавов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов. При отжиге происходит процесс упорядочения в распределении атомов золота и меди в кристаллической структуре, причем степень упорядочения будет наибольшей для атомных соотношений Си: Аи 3: 1 и Си: Аи 1: 1, отвечающих соединениям Cu3Au и CuAu. Поскольку каждый атом в вершине куба принадлежит одновременно восьми соседним ячейкам, на данную ячейку приходится / 8 атома ill.
Рассмотрим увеличение концентрации свободных электронов в кубической гранецентрированной решетке ограниченного а-твердого раствора при добавлении элемента с более высоким номером группы периодической системы по сравнению с растворителем.
| Гексагональная плотнейшая упаковка. Пример. Mg ( a 3 22. с 5 23 А. |
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Ковкость уменьшается при переходе от кристаллов с кубической гранецентрированной решеткой к металлам с центрированной кубической и гексагональной решетками. Условия, определяющие образование или изменение кристаллической структуры, сильно влияют на ковкость металлов или сплавов. До определенной температуры ковкость растет за счет ослабления связи между кристалликами, а после достижения допустимой максимальной температуры ковкость уменьшается – металлы становятся хрупкими. Это связано с образованием окисных пленок между кристаллами.
Эта формула строго справедлива для кристаллов с кубической гранецентрированной решеткой, однако при применении ее для кристаллов с другими типами решеток погрешность незначительна. Следует учитывать, что такого типа расчеты применимы для монокристаллов. Обычно же имеют дело с поликристаллическими сростками.
В гальванических сплавах Си-Sn наряду с кубической гранецентрированной решеткой меди и тетрагональной решеткой олова обнаружены еще две промежуточные фазы. Рассмотрим более подробно несколько систем.
Структура фтористого кальция показана на рис. 10.4. Это кубическая гранецентрированная решетка.
СМ) 6 атомы железа расположены в узлах кубической гранецентрированной решетки. На рис. 22.5 атомы Fe ( II) представлены заштрихованными кружками, а атомы Fe ( III) – светлыми. На рис. а все атомы железа находятся в трехвалентном состоянии; на рис. б половина атомов – это Fe ( II), а другая половина – Fe ( III); атомы щелочных металлов обеспечивают электронейтралыюсть соединения. Они расположены в центрах чередующихся малых кубов; предполагается, что в гидратированпых соединениях молекулы воды также могут располагаться в пустотах основной сетки. Литий и цезий, представляющие собой соответственно очень малый и очень большой ионы, не дают соединений, имеющих такую структуру. На рис. в все атомы железа находятся в двухвалентном состоянии, и внутри каждого малого куба находится атом щелочного металла. Группы CN располагаются между атомами металла вдоль сплошных линий на рис. 22.5, так что каждый атом переходного металла находится в центре октаэдра из 6 атомов С или 6 атомов N. Таким образом, в целом комплекс состава M / M ( CN) 6 образует простую 6-связанную трехмерную сетку.
| Первая зона ник называется первой зоной Бриллюэна Бриллюэна, симметрич -, х.. |
На рис. 2.6 показана первая зона Бриллюэна для кубической гранецентрированной решетки.
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение – это науки, которые занимаются изучением особенностей строения таких структур.
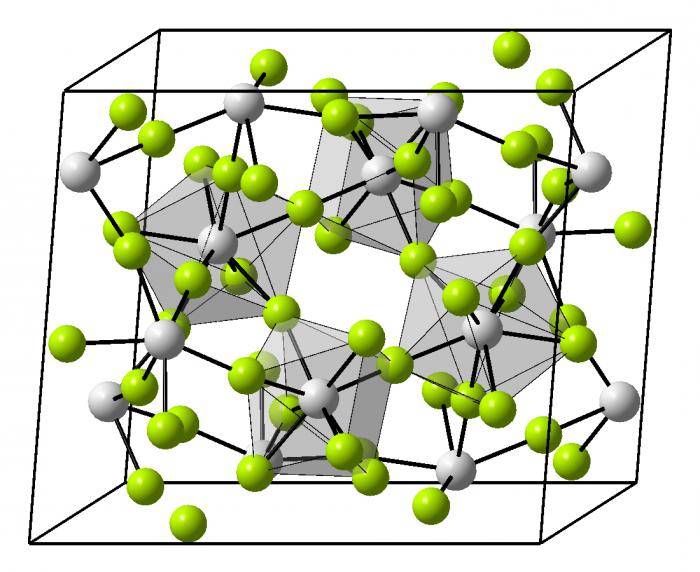
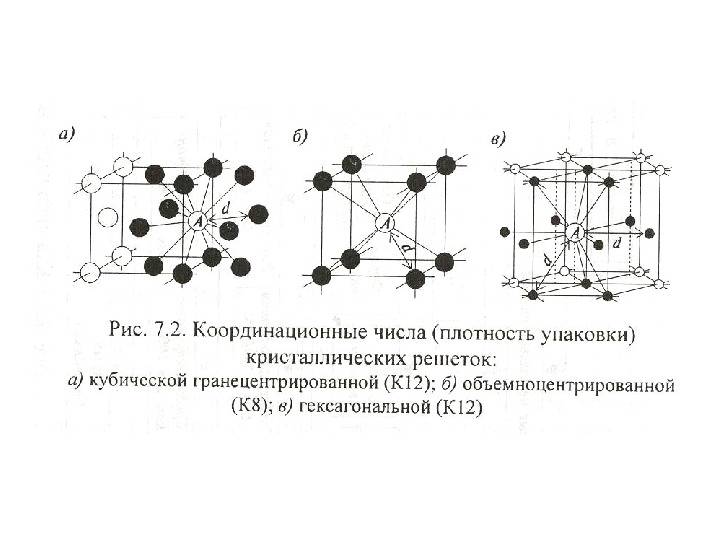
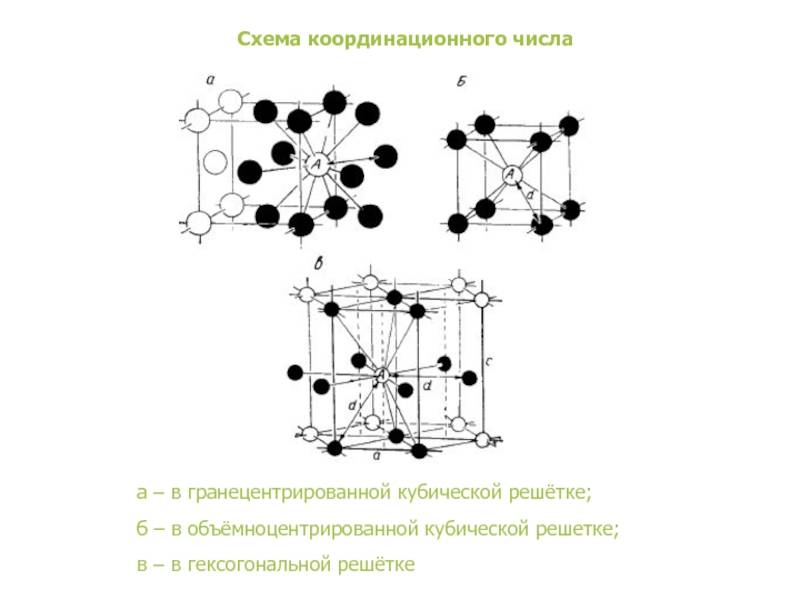
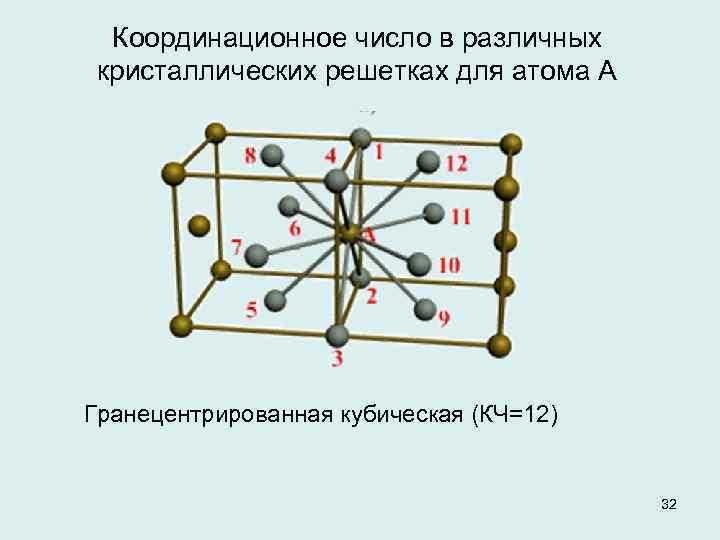
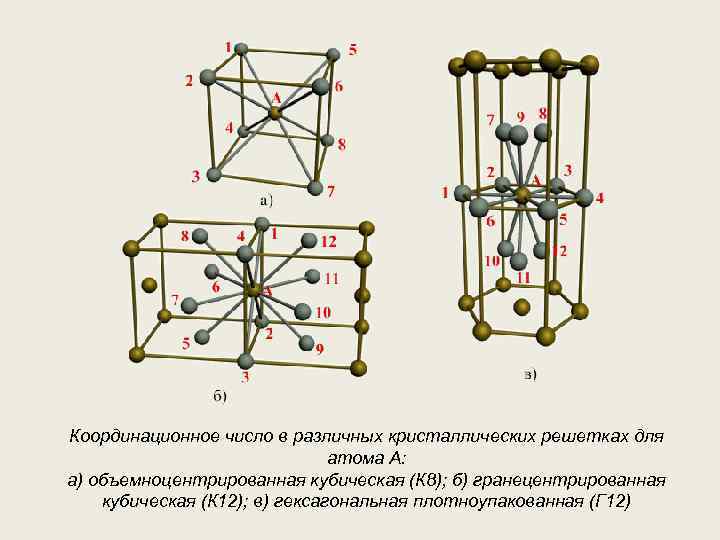
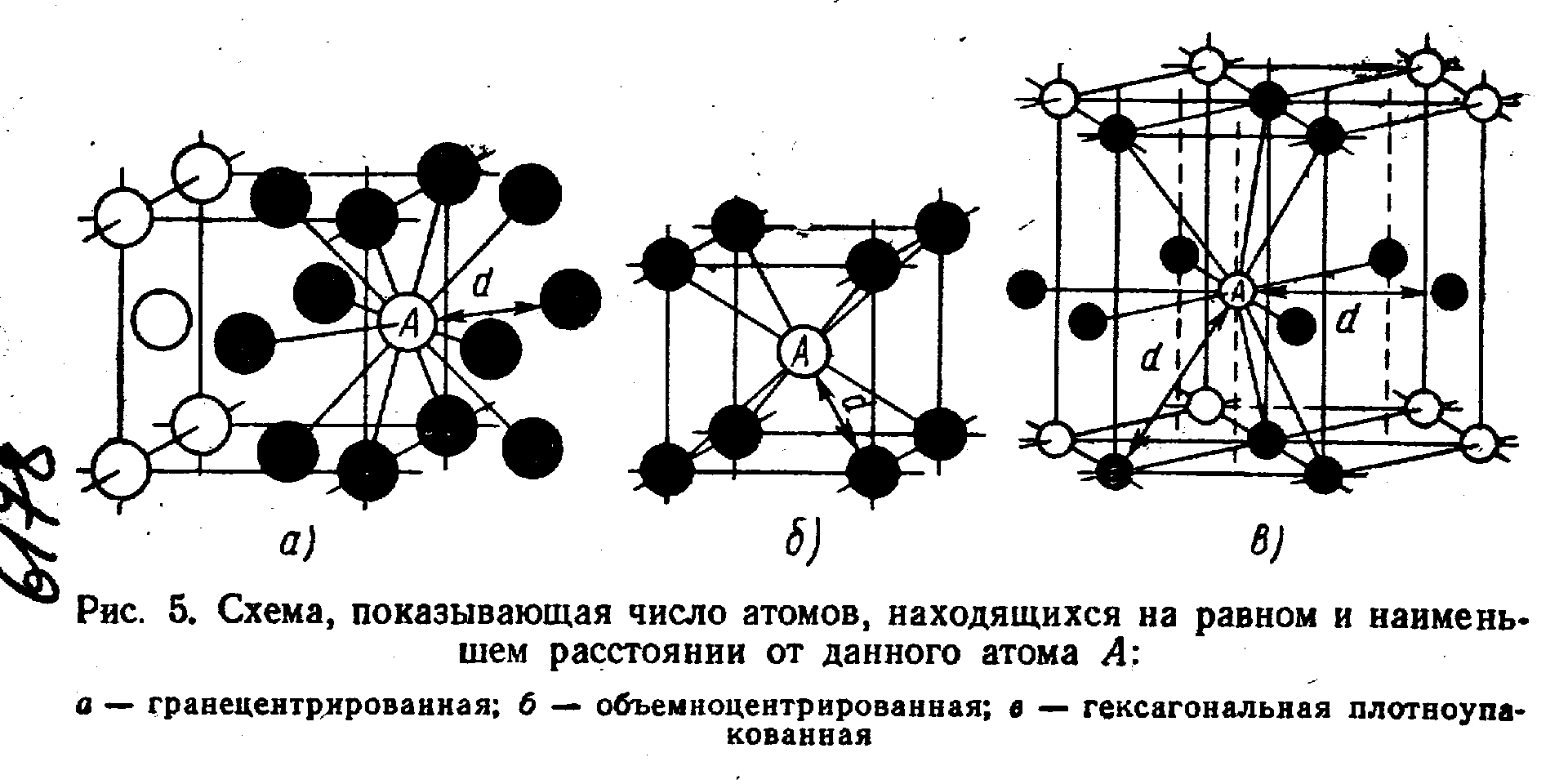
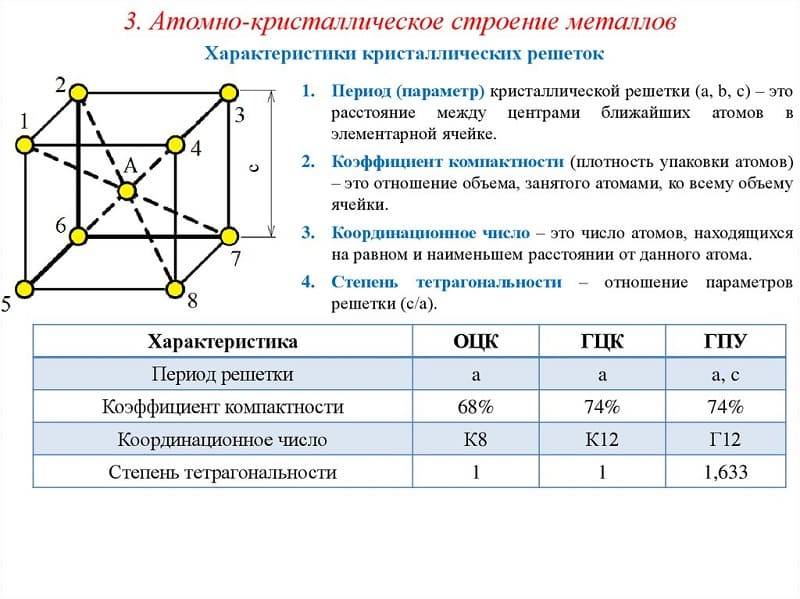
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Читать также: Пресс гранулятор для опилок
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Многоэлементные соединения
Соединения, которые состоят из более чем один элемент (например, бинарные соединения ) часто имеет кристаллическую структуру, основанную на кубической кристаллической системе. Здесь перечислены некоторые из наиболее распространенных.
Структура хлорида цезия
элементарная ячейка хлорида цезия
Пространственная группа структуры хлорида цезия (CsCl) называется Pm3m (в нотации Германа – Могена ) или «221» (в Международных таблицах для кристаллографии). Обозначение Strukturbericht – «B2».
Помимо самого хлорида цезия, структура также проявляется в некоторых других галогенидах щелочных металлов, когда они получены при низких температурах или высоких давлениях. Как правило, эта структура с большей вероятностью будет образована из двух элементов, ионы которых имеют примерно одинаковый размер (например, ионный радиус Cs = 167 мкм, а Cl = 181 мкм).
Координационное число каждого атома в структуре равно 8: центральный катион координируется с 8 анионами в углах куба, как показано, и аналогично центральный анион координируется с 8 катионов по углам куба.
Другими соединениями, имеющими структуру, подобную хлориду цезия, являются CsBr, CsI, высокотемпературный RbCl, AlCo, AgZn, BeCu, MgCe, RuAl и SrTl.
Структура каменной соли
октаэдрической геометрией
пространственная группа структуры каменной соли (NaCl) называется Fm3m (в нотации Германа – Могена ), или «225» (в Международных таблицах для кристаллографии). Обозначение Strukturbericht соответствует “B1”.
В структуре каменной соли или хлорида натрия (галита ) каждый из двух атомов Типы образуют отдельную гранецентрированную кубическую решетку, при этом две решетки взаимопроникают, образуя трехмерный узор в виде шахматной доски. С другой стороны, можно было бы рассматривать эту структуру как гранецентрированную кубическую структуру с вторичными атомами в ее октаэдрических отверстиях.
Примеры соединений с этой структурой включают сам хлорид натрия, наряду с почти всеми другими галогенидами щелочных металлов, и «многие оксиды, сульфиды, селениды и теллуриды двухвалентных металлов». В более общем смысле, эта структура с большей вероятностью будет образована, если катион несколько меньше, чем анион (отношение радиусов катион / анион от 0,414 до 0,732).
Координационное число каждого атома в этой структуре равно 6: каждый катион координирован с 6 анионами в вершинах октаэдра, и аналогично каждый анион координирован с 6 катионами в вершины октаэдра.
Межатомное расстояние (расстояние между катионом и анионом, или половина длины элементарной ячейки a) в некоторых кристаллах со структурой каменной соли составляет: 2,3 Å (2,3 × 10 м) для NaF, 2,8 Å для NaCl, и 3,2 Å для SnTe.
Другими соединениями, имеющими структуру, подобную каменной соли, являются LiF, LiCl, LiBr, LiI, NaF, NaBr, NaI, KF, KCl, KBr, KI, RbF, RbCl, RbBr, RbI, CsF, MgO, PbS, AgF, AgCl, AgBr и ScN.
Структура флюорита и антифлюоритовые структуры (AB 2) также являются структурами Fm3m, но имеют Соотношение ионов 1: 2. Они обозначены положениями Вайкоффа 4a и 8c, тогда как положения структур каменной соли – 4a и 4b.
Структура цинковой обманки
Пространственная группа структуры цинковой обманки называется F43m (в нотации Германа – Могена ) или 216. Обозначение Strukturbericht – «B3».
Структура цинковой обманки (также обозначаемая как «цинковая обманка» “) назван в честь минеральной цинковой обманки (сфалерит ), одной из форм сульфида цинка (β-ZnS). Как и в структуре каменной соли, два типа атомов образуют две взаимопроникающие гранецентрированные кубические решетки. Однако он отличается от структуры каменной соли тем, как две решетки расположены относительно друг друга. Структура цинковой обманки имеет тетраэдрическую координацию : ближайшие соседи каждого атома состоят из четырех атомов противоположного типа, расположенных как четыре вершины . В целом расположение атомов в структуре цинковой обманки такое же, как в кубической структуре алмаза, но с чередующимися типами атомов в разных узлах решетки.
Примеры соединений с такой структурой включают саму цинковую обманку, нитрат свинца (II), многие сложные полупроводники (такие как арсенид галлия и теллурид кадмия ) и множество других бинарных соединений.
Другими соединениями, демонстрирующими структуру, подобную цинковой обманке, являются α-AgI, β-BN, алмаз, CuBr, β-CdS, BP и BAs.