Где используется
Металлургия выпускает продукцию двух категорий: ниобий как металл (чистота от 99%) и сплавы – с молибденом, цирконием, вольфрамом, углеродом.
Металлурги передают продукт химикам, атомщикам, электронщикам, строителям самолетов, ракет.
Это проверенный легирующий компонент. От долей до нескольких процентов к составу разительно улучшают параметры продукции из сталей и сплавов:
- 0,05% ниобия делают алюминиевые материалы «равнодушными» к щелочам.
- 20% – увеличивают электропроводность, прочность меди.
Основные сферы использования металла:
- Конструкции летательных аппаратов.
- Трубы для передачи, контейнеры для хранения «агрессивных» материалов.
- Огнеупоры, специальные сорта стекла, керамики.
- Оболочки сердечников ядерных реакторов.
- Конденсаторы для электронной промышленности.
- Сверхпроводники (соединения ниобия с германием, титаном).
Сплав металла с серебром идет на коллекционные монеты, выпускаемые Центральными банками нескольких стран.
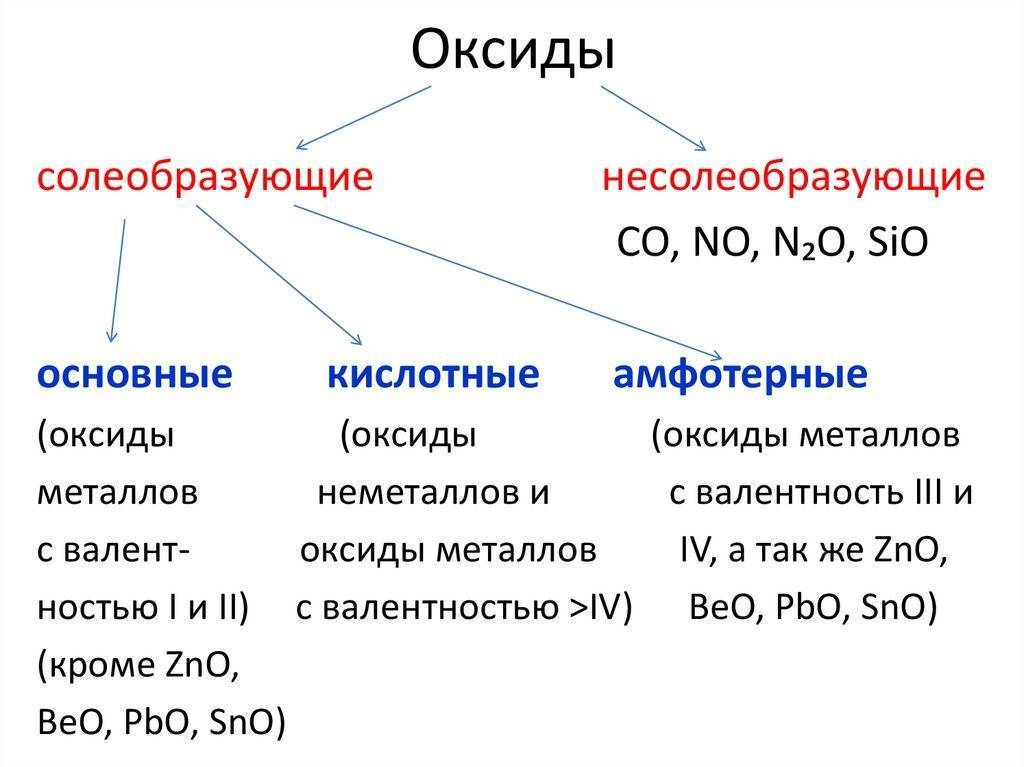
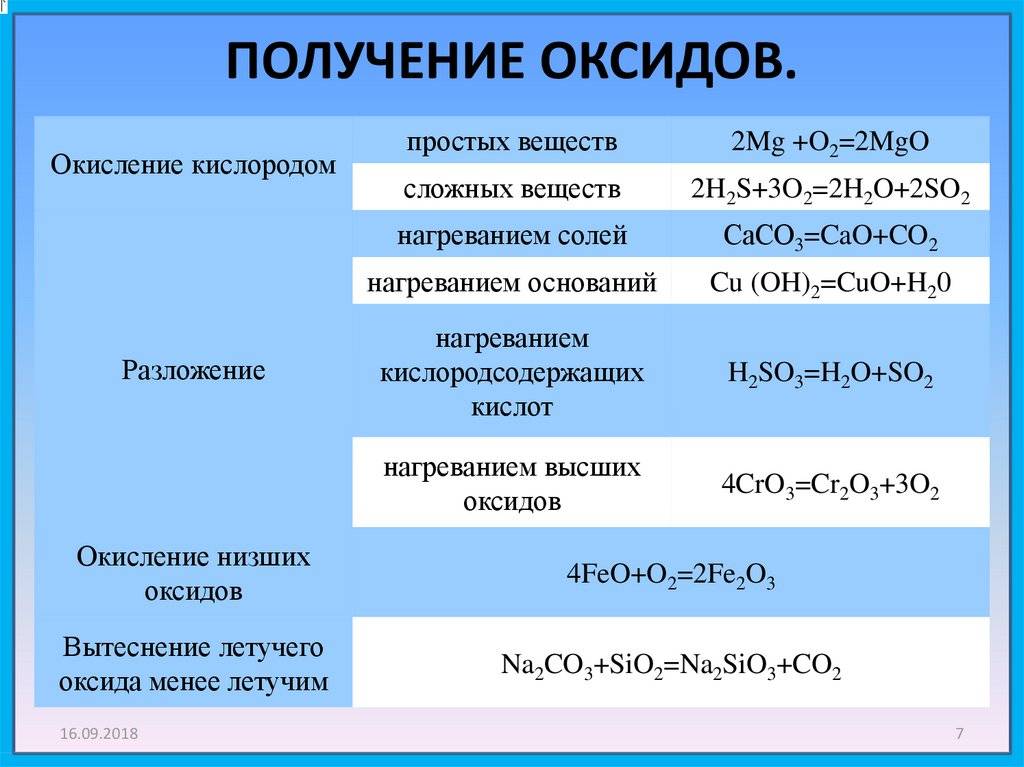
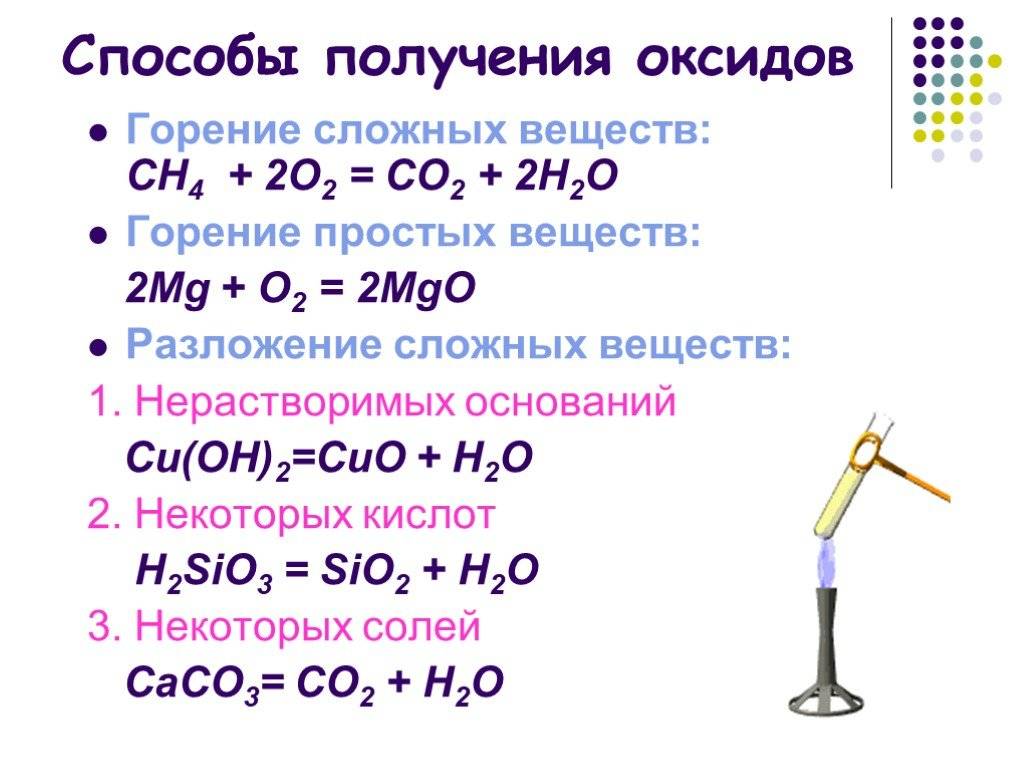
Окислительно-восстановительные свойства оксидов металлов
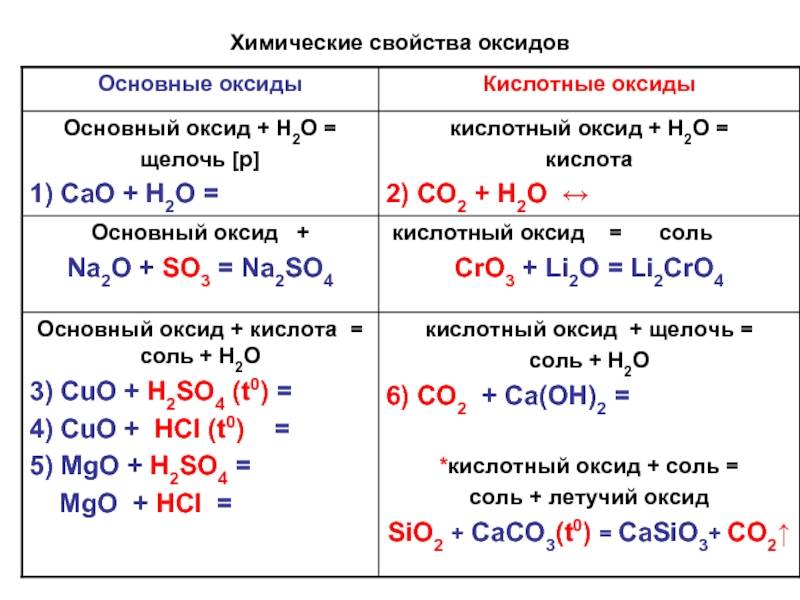
Поскольку в любых оксидах металл находится в окисленном состоянии, все оксиды без исключения способны проявлять окислительные свойства.
Самые распространенные реакции в пирометаллургии — это окислительно-восстановительные взаимодействия между оксидами металлов и различными восстановителями, приводящие к получению металла.
Примеры
2Fe2O3 + 3C = 4Fe + 3CO2
Fe3O4 + 2C = 3Fe + 2CO2
MnO2 +2C = Mn + 2CO
SnO2 + C = Sn + 2CO2
ZnO + C = Zn + CO
Cr2O3 + 2Al = 2Cr + Al2O3
WO3 + 3H2 = W + 3H2O
Если металл имеет несколько степеней окисления, то при достаточном повышении температуры становится возможным разложение оксида с выделением кислорода.
Примеры
4CuO = 2Cu2O + O2
3PbO2 = Pb3O4 + O2,
2Pb3O4 = O2 + 6PbO
Некоторые оксиды, особенно оксиды благородных металлов, при нагревании могут разлагаться с образованием металла.
2Ag2O = 4Ag + O2
2Au2O3 = 4Au + 3O2
Сильные окислительные свойства некоторых оксидов используются на практике. Например,
окислительные свойства оксида PbO2 используют в свинцовых аккумуляторах, в которых за счет химической реакции между PbO2 и металлическим свинцом получают электрический ток.
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
Окислительные свойства MnO2 также используют для получения электрического тока в гальванических элементах (электрических батарейках).
2MnO2 + Zn + 2NH4Cl = + 2MnOOH
Сильные окислительные свойства некоторых оксидов приводят к их своеобразному взаимодействию с кислотами. Так оксиды PbO2 и MnO2 при растворении в концентрированной соляной кислоте восстанавливаются.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O Если металл образует несколько оксидов, то оксиды металла в более низкой степени окисления могут окисляться, т. е. проявлять восстановительные свойства.
Особенно сильные восстановительные свойства проявляют оксиды металлов в низких и неустойчивых степенях окисления, как например. TiO, VO, CrO. При растворении их в воде они окисляются, восстанавливая воду. Их реакции с водой, подобны реакциям металла с водой.
2TiO + 2H2O = 2TiOOH + H2.
Свойства ниобия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Ниобий |
| 102 | Прежнее название | Колумбий |
| 103 | Латинское название | Niobium |
| 104 | Английское название | Niobium |
| 105 | Символ | Nb |
| 106 | Атомный номер (номер в таблице) | 41 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Чарльз Хэтчет, Великобритания, 1801 г. |
| 110 | Год открытия | 1801 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0017 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000019 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 92,90638(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d4 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N12 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 164 пм |
| 205 | Эмпирический радиус атома* | 145 пм |
| 206 | Ковалентный радиус* | 137 пм |
| 207 | Радиус иона (кристаллический) | Nb3+ 86 (6) пм, Nb4+ 82 (6) пм, Nb5+ 78 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 41 электрон, 41 протон, 52 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 5-ая группа (по старой классификации – побочная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, +1, +2, +3, +4, +5 |
| 302 | Валентность | I, II, III, IV, V |
| 303 | Электроотрицательность | 1,6 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 652,13 кДж/моль (6,75885(4) эВ) |
| 305 | Электродный потенциал | Nb3+ + 3e– → Nb, Eo = -1,1 В |
| 306 | Энергия сродства атома к электрону | 86,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 8,57 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 2477 °C (2750 K, 4491 °F) |
| 403 | Температура кипения* | 4742 °С (5015 K, 8567 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 30 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 689,9 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,265 Дж/г·K (при 25 °C), 0,322 Дж/г·K (при 1000 °C) |
| 410 | Молярная теплоёмкость* | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 10,8 см³/моль |
| 412 | Теплопроводность | 53,7 Вт/(м·К) (при стандартных условиях), 53,7 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
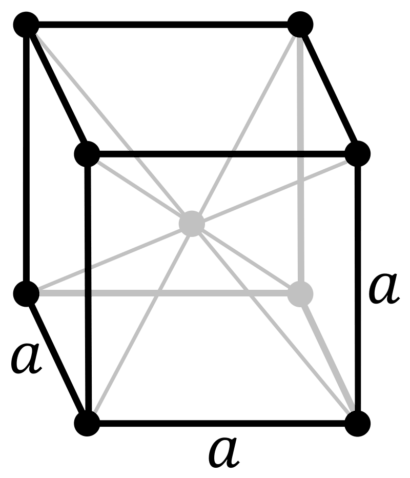
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,301 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 275 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-03-1 |
Примечание:
205* Эмпирический радиус атома ниобия согласно и составляет 146 пм.
206* Ковалентный радиус ниобия согласно и составляет 164±6 пм и 164 пм соответственно.
402* Температура плавления ниобия согласно и составляет 2468 °С (2741 K, 4474 °F) и 2470 °С (2743,15 K, 4478 °F) соответственно.
403* Температура кипения ниобия согласно и составляет 4742 °С (5015 K, 8567 °F) и 4760 °С (5033,15 K, 8600 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) ниобия согласно и составляет 26,8 кДж/моль и 28 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) ниобия согласно и составляет 680 кДж/моль и 662 кДж/моль соответственно.
410* Молярная теплоёмкость ниобия согласно составляет 24,44 Дж/(K·моль).
https://youtube.com/watch?v=teSZkSES8pc
Разновидности сплавов
По значению механических свойств в условиях повышенных температур ниобиевые сплавы подразделяются:
- Низкопрочные. Работают в пределах 1100-1150 ºС. Обладают простым набором легирующих элементов. В основном сюда относится цирконий, титан, тантал, ванадий, гафний. Прочность составляет 18-24 кг/мм2. После перехода критического температурного порога она резко падает и становится аналогичной чистому ниобию. Основное преимущество – высокие пластичные свойства при температурах до 30 ºС и хорошая обрабатываемость давлением.
- Среднепрочные. Их рабочая температура находится в пределах 1200-1250 ºС. Помимо вышеперечисленных легирующих элементов содержат примеси вольфрама, молибдена, тантала. Основное назначение данных добавок – сохранение механических свойств при увеличении температуры. Обладают умеренной пластичностью и хорошо обрабатываются давлением. Ярким примером сплава служит ниобий 5ВМЦ.
- Сплавы высокой прочности. Используются при температурах до 1300 ºС. При кратковременном воздействии до 1500 ºС. Отличаются химическим составом более высокой сложности. На 25% состоят из добавок, основная доля которых приходится на вольфрам и молибден. Некоторые виды данных сплавов отличаются повышенным содержанием углерода, что положительно влияет на значение их жаропрочности. Главным недостатком высокопрочного ниобия является низкая пластичность, которая затрудняет проведения технологической обработки. И, соответственно, получению производственных полуфабрикатов.
Следует учесть, что перечисленные выше категории имеют условный характер и дают лишь общее представление о способе применения того или иного сплава.
Также следует упомянуть о таких соединениях как феррониобий и оксид ниобия.
Феррониобий представляет собой соединение ниобия с железом, где содержание последнего находится на уровне 50%. Помимо основных элементов он включает в себя сотые доли титана, серы, фосфора, кремния, углерода. Точное процентное соотношение элементов нормируется ГОСТом 16773-2003.
Пентаксид ниобия – кристаллический порошок белого цвета. Не подвержен растворению в кислоте и воде. Производится методом сжигания ниобия в среде кислорода. Полностью аморфен. Температура плавления 1500 ºС.
Применение ниобия
Все вышеперечисленные свойства делают металл крайне востребованным в разного рода отраслей производства. Среди множества способов его применения выделяют следующие позиции:
- Использование в металлурги в виде легирующего элемента. Причем ниобием легируют как черные, так и цветные сплавы. Например, добавление всего 0,02% его в состав нержавеющей стали 12Х18Н10Т увеличивает ее износостойкость на 50%. Улучшенный ниобием (0,04%) алюминий становится полностью невосприимчив к щелочи. На медь ниобий действует как закалка на сталь, увеличивая ее механические свойства на порядок. Отметим, что ниобием легируют даже уран.
- Пентооксид ниобия является основным компонентом при изготовлении особо огнеупорной керамики. Также ему нашли применение в оборонной промышленности: бронированные стекла военной техники, оптика с большим углом преломления и прочее.
- Феррониобий используется для легирования сталей. Основная его задача — это увеличение коррозионостойкости.
- В электротехнике применяют для изготовления конденсаторов и токовыпрямителей. Такие конденсаторы отличаются повышенной емкостью и сопротивлением изоляции, малыми размерами.
- Широким применением пользуются соединения кремния и германия с ниобием в области электроники. Из них изготавливают сверхпроводимые соленоиды и элементы генераторов тока.
- В ядерной энергетике служит материалом защитной обшивки термоядерных урановых реакторов. Такое применение обусловлено инертностью ниобия к урану при температурах до 900 ºС, которое позволяет существенно экономить ядерное топливо.
- Сплав 5ВМЦ применяют в аэрокосмической отрасли при конструировании ответственных деталей термореактивных двигателей. В частности, применение 5ВМЦ при изготовлении лопаток газовых турбин, способствует увеличению их долговечности.
- Карбид вольфрама является компонентом твердых сплавов, которые в машиностроении применяются как режущий инструмент.
- Благодаря своей коррозионной стойкости и высокой пластичности ниобий нашел применение в аппаратуре и приборах химической промышленности.
Химические свойства V, Nb, Ta
Ванадий является более активным металлом, чем ниобий и тантал, но менее, чем титан. Из кислот-неокислителей, ванадий вступает в реакцию только с плавиковой кислотой:
2V+12HF = 2H3[VF6]+3H2↑
С горячим раствором концентрированной серной кислоты ванадий окисляется до соединений ванадила:
2V+12HF = 2H3[VF6]+3H2↑
Азотная кислота с плотностью выше 1,35 г/см3 окисляет и растворяет ванадий:
V+3H2SO4 = VOSO4+2SO2↑+3H2O
Полностью окисляют ванадий до высших степеней окисления хлорная, хлорноватая, бромноватая, йодноватая и пероксодисерная кислоты: HClO4, HClO3, HBrO3, HIO3, H2S2O8. Лучше всего ванадий растворяют царская водка и смесь азотной и плавиковой кислоты. При н.у. ванадий практически не окисляется на воздухе, не реагирует с растворами органических кислот и щелочей.
Реакционная активность ванадия повышается по мере роста температуры – порошок ванадия при нагревании на воздухе воспламеняется. С азотом при температуре 1000°C ванадий образует нитрид VN, с водородом – гидрид VH (500-900°C). Легче всего ванадий реагирует с галогенами, образуя при нагревании фториды (VF5), тетрахлориды (VCl4), трибромиды (VBr3), дииодиды (VI2).
Ниобий, и в большей степени тантал, еще менее склонны вступать в реакции с другими веществами, что объясняется наличием прочной защитной оксидной пленки на их поверхности. При н.у. ниобий медленно реагирует только со смесью азотной и плавиковой кислот, а тантал вообще с кислотами не реагирует. Даже при нагревании до температуры красного каления на воздухе слитки ниобия и тантала только тускнеют с поверхности. Измельченные в порошок ниобий и тантал при нагревании до 900°C сгорают в кислороде, мелкоизмельченный ниобий воспламеняется в расплавленной селитре. С галогенами ниобий и тантал взаимодействуют при нагревании до высоких температур. Также при значительном нагревании тантал и ниобий реагируют с серой, углеродом, аммиаком, азотом, сероводородом, водородом (реакция обратима).
История
Чарльз Хэтчетт идентифицировал элемент колумбий в минерале, обнаруженном в Коннектикуте, США.
Изображение эллинистической скульптуры, изображающей Ниобу, работы Джорджо Соммера
Ниобий был идентифицирован английским химиком Чарльзом Хэтчеттом в 1801 году. Он обнаружил новый элемент в образце минерала, который был отправлен в Англию из Коннектикута , США в 1734 году Джоном Уинтропом FRS (внуком Джона Уинтропа Младшего ), и назвал минерал колумбитом. и новый элемент колумбий в честь Колумбия , поэтического названия Соединенных Штатов. Ниобий обнаружен Hatchett, вероятно , смесь нового элемента с танталом.
Впоследствии возникла значительная путаница по поводу разницы между колумбием (ниобием) и близким ему танталом. В 1809 году английский химик Уильям Хайд Волластон сравнил оксиды, полученные из колумбия-колумбита с плотностью 5,918 г / см 3 , и тантала- танталита с плотностью более 8 г / см 3 , и пришел к выводу, что эти два оксида, несмотря на значительная разница в плотности, были идентичны; таким образом он сохранил название тантал. Этот вывод был оспорен в 1846 году немецкий химик Генрих Розе , который утверждал , что существуют два различных элемента в образце танталит, и назвал их после того, как дети Тантала : ниобий (от Ниоба ) и pelopium (от Пелопсом ). Эта путаница возникла из-за минимальных наблюдаемых различий между танталом и ниобием. Заявленные новые элементы пелопий , ильмений и диан фактически идентичны ниобию или смесям ниобия и тантала.
Различия между танталом и ниобием были недвусмысленно продемонстрированы в 1864 году Кристианом Вильгельмом Бломстрандом и Анри Этьеном Сент-Клер Девиль , а также Луи Дж. Тростом , который определил формулы некоторых соединений в 1865 году и, наконец, швейцарским химиком Жаном Шарлем Галиссаром. де Мариньяк в 1866 году, который доказал, что существует только два элемента. Статьи об ильмении продолжали появляться до 1871 года.
Де Мариньяк первым подготовил металл в 1864 году, когда он восстановил хлорид ниобия, нагревая его в атмосфере водорода . Хотя де Marignac был способен производить тантал-ниобий бесплатно в большем масштабе 1866 г., он не был до начала 20 – го века , что ниобий был использован в лампы накаливания нити, первого коммерческого применения. Это использование быстро устарело из-за замены ниобия вольфрамом , который имеет более высокую температуру плавления. То, что ниобий улучшает прочность стали, было впервые обнаружено в 1920-х годах, и это применение остается его основным применением. В 1961 году американский физик Юджин Кунцлер и его коллеги из Bell Labs обнаружили, что ниобий-олово продолжает демонстрировать сверхпроводимость в присутствии сильных электрических токов и магнитных полей, что сделало его первым материалом, поддерживающим высокие токи и поля, необходимые для полезного высокого напряжения. силовые магниты и электрические машины . Это открытие позволило – два десятилетия спустя – производить длинные многожильные кабели, скрученные в катушки, для создания больших и мощных электромагнитов для вращающегося оборудования, ускорителей частиц и детекторов частиц.
Присвоение имени элементу
Колумбий (символ «Cb») – это название, которое Хатчетт дал после открытия этого металла в 1801 году. Название отражало, что типовой образец руды прибыл из Америки ( Колумбия ). Это название продолжало использоваться в американских журналах – последняя статья, опубликованная Американским химическим обществом с колумбием в названии, датируется 1953 годом, – в то время как ниобий использовался в Европе. Чтобы положить конец этой путанице, название ниобий было выбрано для элемента 41 на 15-й конференции Союза химиков в Амстердаме в 1949 году. Год спустя это название было официально принято Международным союзом чистой и прикладной химии (IUPAC) через 100 лет. противоречий, несмотря на хронологический приоритет названия Columbium . Это был своего рода компромисс; ИЮПАК принял вольфрам вместо вольфрама из уважения к использованию в Северной Америке; и ниобий вместо колумбия в соответствии с европейским использованием. Хотя многие химические общества и правительственные организации США обычно используют официальное название ИЮПАК, некоторые металлурги и общества металлургов все еще используют оригинальное американское название « колумбий .
Ниобий – свойства, применение и сплавы ниобия

Химические элементы ниобий и тантал неразрывно связаны между собой еще со времени открытия. Их взаимосвязь проявляется даже мифологически: название первого, происходит от имени Ниоба, которая в древнегреческой мифологии была дочерью царя Тантала. Генрих Розе приложил свою «легкую руку» к тому, чтобы наименование Nb крепко закрепилось в научных кругах и таблице Менделеева. Исследования немецкого химика в области изучения свойств минерала колумбита позволили выделить окислы двух металлов (1844 год). Первый относился к уже известному тогда танталу, второй оказался оксидом нового элемента – ниобия.
Производство
После отделения от других минералов смешанные оксиды тантала Ta2O5 и ниобия Nb2O5 получены. Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta2O5+ 14 HF → 2 H 2 + 5 H 2O
- Nb2O5+ 10 HF → 2 H 2 + 3 H 2O
Первое разделение в промышленном масштабе, разработанное де Мариньяком, использует различные растворимости комплексного фторида ниобия и тантала , моногидрата оксипентафторониобата дикалия (K 2 · H 2 O) и гептафтортанталата дикалия (K 2 ) в воде. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон. Комплексные фториды ниобия и тантала экстрагируются отдельно из органического растворителя водой и либо осаждаются добавлением фторида калия для получения комплекса фторида калия, либо осаждаются аммиаком как пятиокись:
- H2 + 2 KF → K 2 ↓ + 2 HF
Далее по:
- 2 H 2 + 10 NH 4 OH → Nb 2O5↓ + 10 NH 4 F + 7 H 2O
Для восстановления до металлического ниобия используют несколько методов. электролиз расплавленной смеси K 2 и хлорида натрия равен единице; другой – восстановление фторида натрием. С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2O5восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2O5+ Fe 2O3+ 12 Al → 6 Nb + 2 Fe + 6 Al 2O3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия. В результате получают оксид алюминия и феррониобий, сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Дальнейшая очистка необходима для получения класса сверхпроводящих сплавов. Электронно-лучевая плавка в вакууме – метод, используемый двумя основными дистрибьюторами ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия.. По оценкам Геологической службы США, добыча увеличилась с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4 400 000 тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год.
| Страна | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30,000 | 22,000 | 26,000 | 29,000 | 29,900 | 35,000 | 40,000 | 57,300 | 58,000 | 58,000 | 58,000 | 58,000 | 45,000 | 53,100 |
| Канада | 2,290 | 3,200 | 3,410 | 3,280 | 3,400 | 3,310 | 4,167 | 3,020 | 4,380 | 4,330 | 4,420 | 4,630 | 4,710 | 5260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 | 30 | 30 | 190 | 170 | 40 | 35 | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Весь мир | 32,600 | 25,600 | 29,900 | 32,800 | 34,000 | 38,700 | 44,500 | 60,400 | 62,900 | 62,900 | 62,900 | 63,000 | 50,100 | 59,400 |
Меньшие количества обнаружены на месторождении Каньяка в Малави (рудник Каньяка ).
Историческая справка
Открыт в 1801 англ. химиком Ч. Хатчеттом и назван «колумбием» (по происхождению минерала, из которого был выделен Хатчеттом в виде оксида). В течение нескольких десятилетий колумбий и близкий ему по свойствам тантал считали одним и тем же элементом. Индивидуальность колумбия была доказана в 1844, когда он был вторично «открыт» нем. химиком Г. Розе и назван «Н.» (по имени Ниобы – дочери Тантала в др.-греч. мифологии; назв. подчёркивает сходство свойств Н. и тантала). В 1845 Розе установил, что Н. идентичен колумбию. В ряде стран (США, Англия) более 100 лет использовалось назв. «колумбий» (Columbium, Cb). Назв. «Н.» утверждено ИЮПАК в 1950.
Что на сегодня известно о Nb
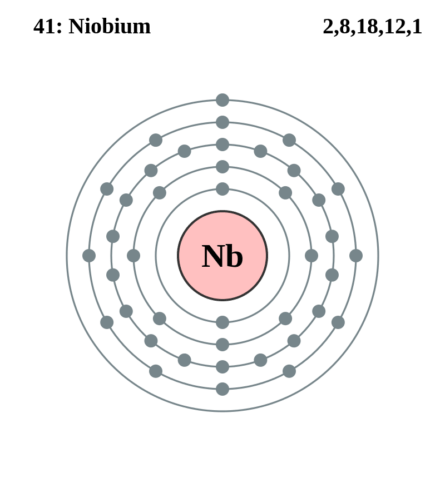
Ниобий – химический элемент, занимает место в V группе таблицы Менделеева, атомный номер – 41, атомная масса 92,9. Как и многие металлы, он характеризуется серо-стальным блеском. Формула элемента электронно выглядит как 4d45sl, графическая интерпретация оболочек ниобия следующая: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 4 5s 1.
Тугоплавкость считается самым важным физическим свойством металла, именно благодаря ей ниобий стал востребованным во многих областях промышленности. Плавится и кипит при температурах 2468 и 4927 0С, соответственно. Плотность вещества при комнатных условиях оценивается как 8.57 грамм в кубическом сантиметре. Металл обладает парамагнитностью. Имеет ОЦК кристаллическую решетку с радиусом 3.294 ангстрем.

Слитки ниобия
Химические свойства ниобия и танталу также достаточно близки. Металлы отличаются высокой устойчивостью к воздействию отрицательных температур и большинства агрессивных сред. Например, заметное окисление Nb на воздухе наблюдается только при нагреве вещества свыше 200 0С. Список кислот, не воздействующих на ниобий, достаточно широк и включает:
соляную;
серную;
хлорную;
фосфорную.
Также металл устойчив к водным растворам аммиака. Уникальное свойство элемента образовывать диэлектрическую оксидную пленку в составе кислых электролитов нашло применение в изготовлении миниатюрных высокоемкостных конденсаторов, где элемент заменяет более дорогостоящий тантал.
Видео – Ниобий, химические и физические свойства:
Физические и химические свойства
Ниобий имеет химические свойства схожие с химическими качествами тантала
Анализируя главные характеристики ниобия, необходимо уделять большое внимание приведенным ниже моментам:
- Стойкость к влиянию разных видов коррозии. Сплавы, получаемые при внедрении этого элемента в состав, обладают высокими коррозионностойкими качествами.
- Рассматриваемый элемент химии показывает высокий температурный показатель плавления. Как говорит практика, у многих сплавов температура плавления более 1 400 градусов по Цельсию. это затрудняет процесс обработки, но выполняет металлы незаменимы в различных областях деятельности.
- Главные физические свойства также отличаются легкостью сваривания приобретаемых сплавов.
- При минусовых температурах структура элемента остается фактически неизменной, что дает возможность сохранить свойства эксплуатации металла.
- Особенное строение атома ниобия определяет сверхпроводящие качества материала.
- Атомная масса составляет 92,9, валентность зависит от свойств состава.

Главным положительным качеством вещества считается собственно тугоплавкость. Собственно поэтому он стал применяться в разных промышленных отраслях. Плавление вещества проходит при температуре примерно 2 500 градусов по Цельсию. Некоторые сплавы и совсем плавятся при рекордной температуре 4 500 градусов по Цельсию. Плотность вещества очень высокая, составляет 8,57 грамма на сантиметр кубический. Необходимо учесть, что металл отличается парамагнитностью.
На кристаллическую решётку не оказывают влияния следующие кислоты:
Не оказывает влияние на металл и растворы воды хлора. При определенном влиянии на металл на его поверхности образуется диэлектрическая оксидная пленка. Собственно поэтому металл стал применяться при изготовлении маленьких высокоемкостных конденсаторов, которые также делаются из более очень дорогого тантала.
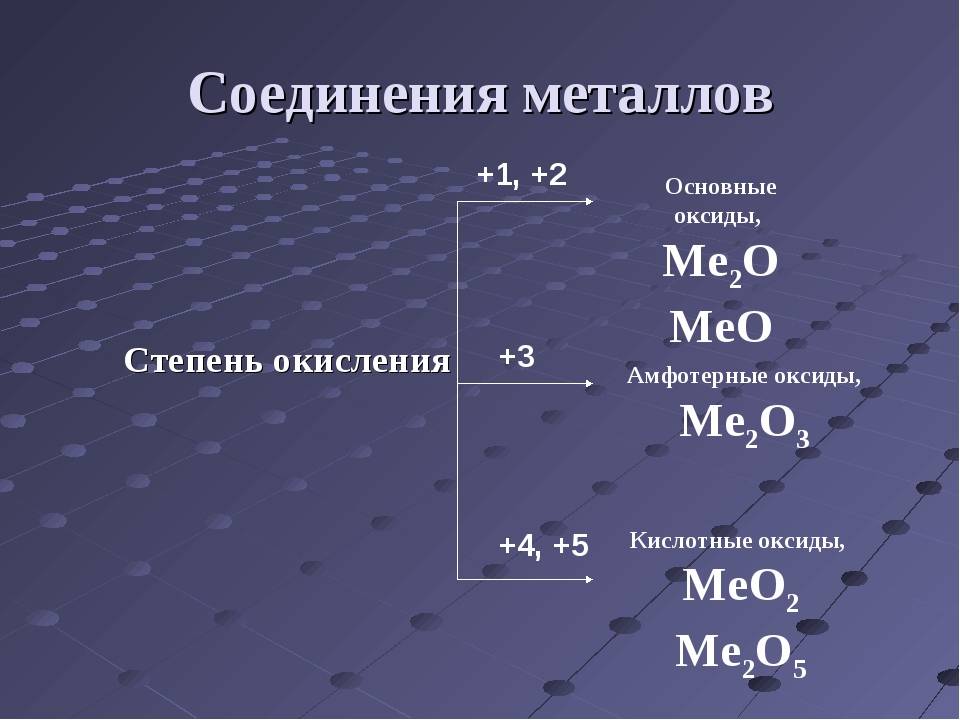
Химические соединения металлов
Среди таковых следует назвать несколько основных классов веществ, которые являются продуктами взаимодействия металлов с другими элементами и веществами.
- Оксиды, гидриды, нитриды, силициды, фосфиды, озониды, карбиды, сульфиды и прочие – бинарные соединения с неметаллами, чаще всего относятся к классу солей (кроме оксидов).
- Гидроксиды – общая формула Ме+х(ОН)х.
- Соли. Соединения металлов с кислотными остатками. Могут быть разными:
- средние;
- кислые;
- двойные;
- основные;
- комплексные.
4. Соединения металлов с органическими веществами – металлорганические структуры.
5. Соединения металлов друг с другом – сплавы, которые получаются разными способами.