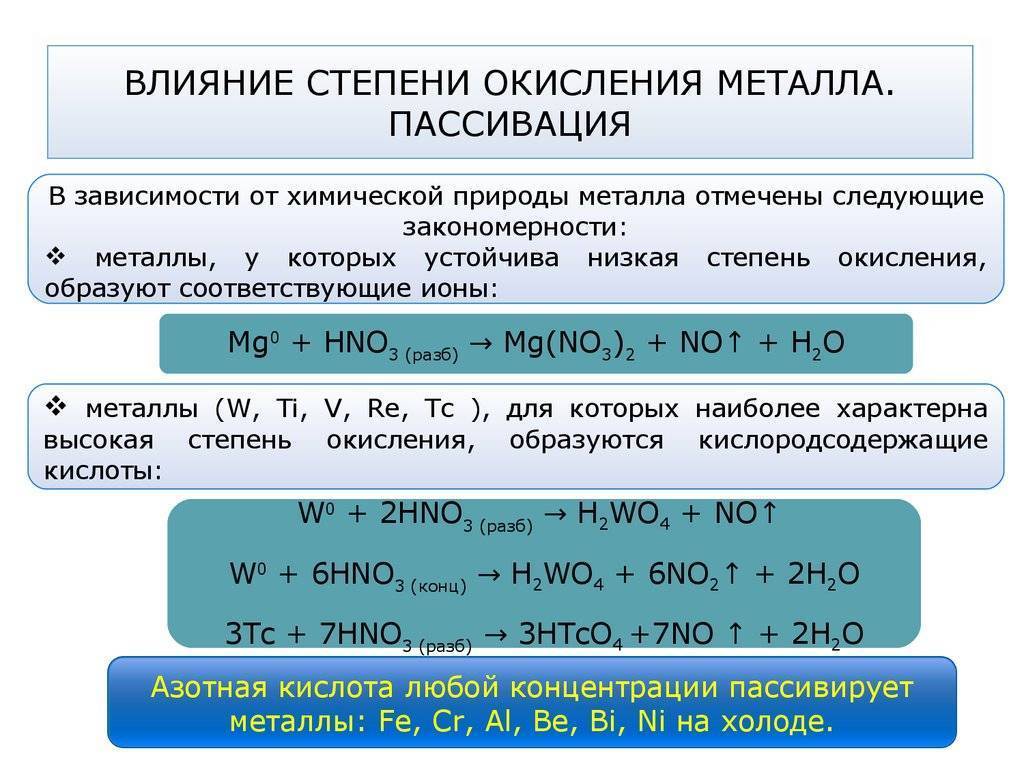
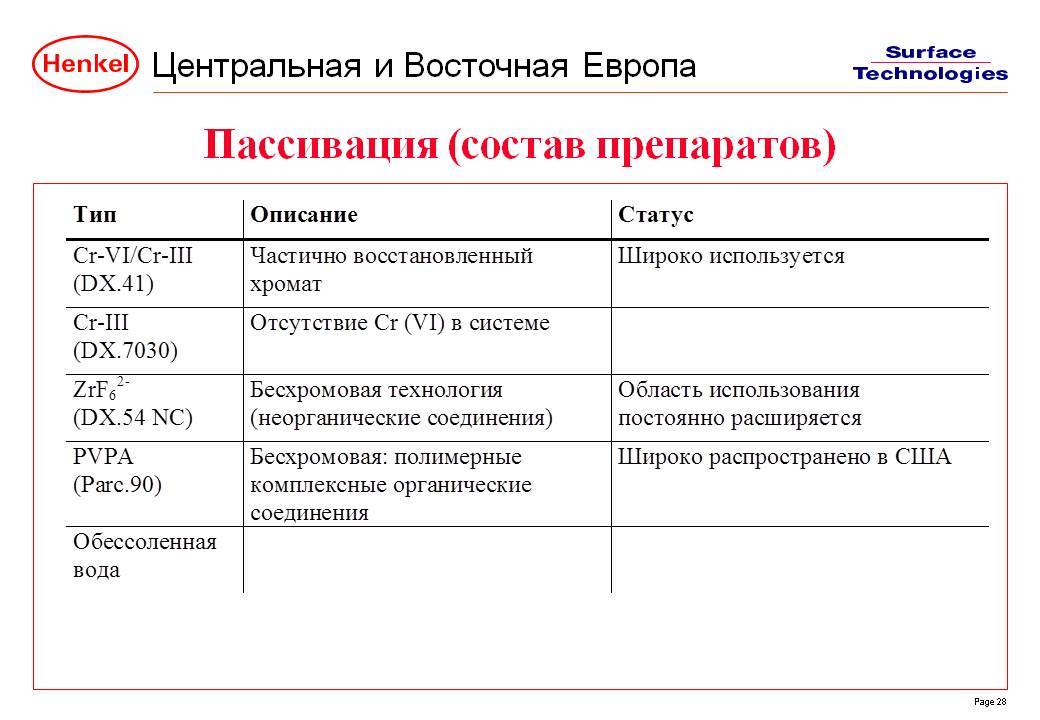
Технология пассивации металла, виды и составы
Пассивация — это формирование на поверхности металла тонких оксидных или солевых пленок, которые защищают его от внешней коррозии. Такое покрытие препятствует контакту металла с кислородом и агрессивными средами. При пассивировании защитные пленки могут образовываться на металлической поверхности как естественным, так и искусственным путем. В первом случае они состоят из оксидов химических элементов, входящих в состав самого металла, а во втором могут включать в себя оксиды и соли других химических элементов. Например, чистый алюминий естественным способом образует очень стойкую оксидную пленку, поэтому устойчив к большинству видов коррозии. А вот изделия из его сплавов, содержащих химически активные компоненты, уже нуждаются в искусственной коррозионной защите и поэтому подвергаются пассивированию в солевых растворах.
Пассивацию широко применяют для защиты поверхностей изделий из стали, меди, никеля, алюминия и их сплавов. Даже защитные цинковые и кадмиевые покрытия пассивируют солями хрома для повышения их коррозионной и механической стойкости. Пассивирование металла вызывает образование на его поверхности слоя оксидов или солей толщиной в несколько микрон, что практически не влияет на геометрические размеры изделий. С другой стороны, такие пленки могут снижать контактную проводимость основного материала, но, как правило, в меньшей степени, чем слой корродированного металла.
Пассивация – сталь – Большая Энциклопедия Нефти и Газа, статья, страница 1
Пассивация – сталь
Пассивация стали происходила кольцеобразно вокруг никелевого катода. Защитное действие никелевого катода возрастает с увеличением радиуса катода и уменьшается с увеличением скорости движения раствора и концентрации щелочи.
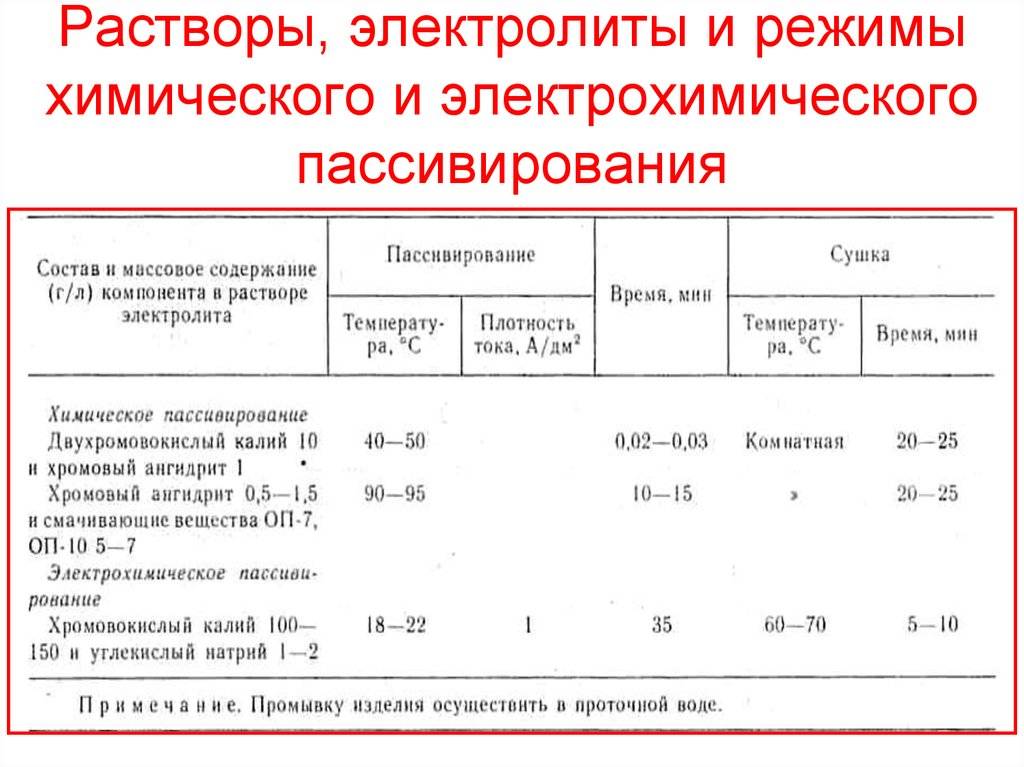
Пассивацию фосфатированной стали производят раствором хромового ангидрида с концентрацией до 0 2 г / л, рН раствора увеличивают с 2 5 – 2 8 до 4 – 4 5 введением гидроокиси натрия. Для приготовления пассивирующего раствора используют обессоленную воду; пассивирующий раствор меняют в среднем один раз в неделю. В ванне пассивирования каждые 3 ч определяют свободную кислотность в точках ( 0 45 – 0 55), а также температуру и давление.
Потенциалы пассивации сталей Х17, ОХ17Т и 1Х17Н2 составляют примерно – 250 мв, стали Х17Н – 300 мв и стали Х17Д – 200 мв.
Так как пассивация стали происходит в интервале значений показателя рН раствора от 11 3 до 13, арматурная сталь может считаться защищенной от коррозии, если со всех сторон покрыта бетонным слоем достаточной толщины, а бетон изготовлен с соблюдением соответствующих требований. Минимальная толщина защитного слоя бетона при контакте с водой и грунтом ( BGII – ГУ) по TGL 33408 / 02 в общем случае принимается равной 30 мм, при концентрации хлоридов в воде более 1000 мг / л – 50 мм.
Для обеспечения надежной пассивации стали конденсатного и питательного трактов общую концентрацию кислорода в воде необходимо поддерживать на уровне выше 100 мкг / кг. Верхний предел концентрации кислорода для предотвращения интенсивного вымывания отложений меди, накопившихся в тракте блока, должен быть около 300 мкг / кг.
В растворах роданидов пассивация сталей достигается увеличением рН раствора, легированием стали молибденом, а также анодной поляризацией.
Для облегчения процесса пассивации стали желательно обеспечить предварительное контактирование стали с протектором и только после этого постепенно погружать систему в раствор или медленно наполнять коррозионным раствором предварительно замкнутую на протектор емкость.
Повышение температуры вызывает затруднение пассивации сталей, что выражается в увеличении тока пассивации ( рис. 54), смещении потенциала пассивации ( см. рис. 50) и потенциала полной пассивации ( рис. 55) в положительную сторону.
Как видно, в первой серии опытов пассивация стали достигается легче, при значительно меньшей относительной площади протектора. В этих условиях для пассивации стали требуются меньшие токи вследствие того, что образцы нержавеющей стали в исходном состоянии в какой-то степени запассивированы кислородом воздуха, и, кроме того, постепенное погружение стали в раствор приводит к значительному увеличению отношения площади катода к аноду в первоначальный момент.
Проведенными – исследованиями показано, что склонность к пассивации сталей в горячих концентрированных хлоратсодер-жащих растворах щелочи усиливается по мере понижения содержания в сплаве никеля. Легче всего в этих условиях пассивируется безникелевая сталь 15Х25Т, труднее – сталь 12Х18Н10Т; эко-номнолегированные стали занимают промежуточное положение.
С увеличением содержания никеля снижается критическая плотность тока пассивации стали и расширяется область устойчивой пассивности. KCNS зависимость потенциала питтингообразования стали 12Х18Н10Т от температуры, как и для никеля, имеет минимум при 50 С, что согласуется с данными, полученными в работе для той же стали при близких значениях рН и концентрации раствора. Поверхность хромоникелевых сталей, как и чистого никеля, покрывается слоем нерастворимых сульфидов, которые удаляются с поверхности механическим способом. Увеличение содержания частиц 35S на стали 12Х18Н10Т с ростом температуры, вероятно, связано с более интенсивным образованием NiS на поверхности хромоникелевой стали.
Молибден, который является стабилизатором ферритной фазы, способствует пассивации стали ( повышает нижнюю границу потенциала питтингообразования) и тем самым повышает коррозионную стойкость. Добавка Мо способствует также повышению анодной поляризуемости, возможно, вследствие адсорбции на поверхности стали образующихся продуктов коррозии, но механизм действия Мо, очевидно, иной, чем у Ni, так как молибден не только уменьшает питтингообразование, но и снижает вероятность подповерхностной коррозии.
Страницы: 1 2 3 4
Пассивация металла — принцип, назначение, виды
Нержавеющая сталь – это особый металл, длительное время не поддающийся коррозии. Из нее изготавливаются различные детали и декоративные предметы. Но если изделие будет использоваться в сложных условиях, в которых коррозия грозит даже ему, то обязательно проводится пассивирование металла.
Механизм пассивации
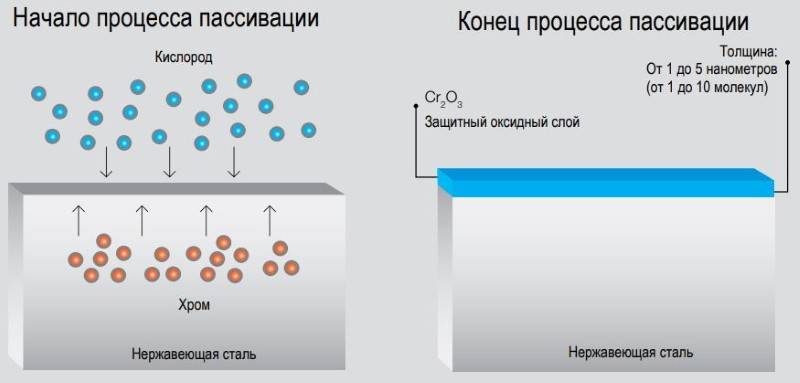
При взаимодействии металлов с теми или иными компонентами растворов (расплавов) в определённом диапазоне потенциалов на поверхности металла образуются адсорбционные или фазовые слои (плёнки). Эти слои образуют плотный, почти непроницаемый барьер, благодаря чему коррозия сильно замедляется или полностью прекращается.
Пассивация проводится химически или электрохимически. В последнем случае создаются условия, когда ионы защищаемого металла под действием тока переходят в раствор, содержащий ионы, способные к образованию очень малорастворимых соединений.
: Отжиг стали — температура, режимы, виды
Химическое пассивирование
Химическое пассивирование проводят окунанием либо непосредственным нанесением реагентов на саму поверхность без применения электрического тока. В зависимости от используемых веществ, химическое пассивирование может проводиться при комнатной температуре или с подогревом электролита.
Причины устойчивости металла
Процесс коррозии характеризуется тем, что постепенно окисляясь под воздействием негативных факторов, поверхность нержавеющей стали разрушается. Если не предпринимать никакие меры, то деструкция будет поражать более глубокие его слои.
Таблица устойчивости металлов в разных средах
Пассивирование металла позволяет избежать представленной проблемы. Поверхность изделия покрывается защитной оксидной пленкой, а специальные добавки, входящие в раствор для обработки, улучшают свойства нержавейки. Новый материал не имеет повреждений.
В промышленных условиях есть возможность получить идеальный по толщине и однородности слой защиты от коррозии. Если условия, в которых будет использоваться изделие, не слишком агрессивные, то дополнительная обработка ему не нужна
Важно помнить, что механическое повреждение стали дает толчок коррозионным процессам
Электрохимическое пассивирование
Проводят в растворах окислителей при воздействии электрического тока. Под воздействием тока частицы оседают на поверхности защищаемого изделия, создавая защитный слой. Этот слой, состоящий из малорастворимых соединений, получается более равномерный, чем при использовании метода химического пассивирования.
Пассивация меди проводится чаще всего с применением хроматных растворов, т.к. после обработки наблюдается хорошая коррозионная стойкость металла в растворах нейтральных солей и средах, содержащих SO2.
Пассивирование оцинкованных изделий проводят в растворах, содержащих 200 г/л Na2Cr2O7•2H2O и 8 – 10 мл/л H2SO4. Обработку производится чаще всего методом окунания в раствор на 5 – 30 секунд. При выдержке 5 секунд пленка получается радужная с зеленоватым оттенком. При длительности 30 секунд – коричневая.
Виды пассивации
В настоящее время по способу проведения пассивации выделяются следующие виды пассивации:
Данный вид пассивации заключается в том, чтобы нанести на поверхность металла солей и кислых растворов наряду с электролитом. В итоге проведения данной процедуры на поверхности металла оседают заряженные частицы, которые образую тонкую пленку, обеспечивающую надежную защиту от коррозии.
Данная процедура подразумевает обработку металлов химическими реагентами, которые образуют на их поверхности защитную пленку. Для этого применяются растворы, которые состоят из никеля, хрома и других элементов. Они делают структуру металла более плотной и твердой.
: Пермаллой — магнитная проницаемость, свойства, применение
Суть и описание процесса пассивации металла
При пассивировании поверхности металлических изделий обрабатывают растворами химических соединений, обладающих окислительными свойствами. В этой роли чаще всего выступают кислоты, нитриты и растворы солей хрома (реже — молибдена). Нанесение раствора на поверхность металлических заготовок производится методом погружения или вручную, с помощью специального оборудования. Применяемые при пассивировании растворы обычно состоят из основного реагента и нескольких добавок, ускоряющих и стабилизирующих процесс пассивации.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Пассивирование — сталь — Большая Энциклопедия Нефти и Газа, статья, страница 1
Пассивирование — сталь
Пассивирование стали применяют также после травления для межоперационной защиты перед механической обработкой ( шлифованием и др.) — Для этих целей применяют раствор из 8 3 г / л нитрита натрия, 3 1 г / л карбоната натрия; температура раствора 65 — 75 С, продолжительность обработки 0 5 — 1 мин.
Пассивирование стали широко используют для защиты от коррозии в период эксплуатации и межоперационного хранения.
Пассивирование стали типа 18 — 8 под действием азотной кислоты обусловлено присутствием азотистой кислоты.
Процесс пассивирования сталей в указанных растворах проходит без выделения газа. Начало выделения газа свидетельствует о травлении металла, которое препятствует образованию на металле пассивной пленки.
Оксидирование или пассивирование стали ( воронение, чернение) заключается в создании поверхностного слоя плотной оксидной пленки, хорошо держащейся на основном металле. Оксидирование производится либо путем погружения детали в расплавленные соли, либо электролитическим путем.
Другим способом пассивирования стали является воронение, которое также сводится к образованию на ее поверхности тонкой плотной и сплошной пленки из окислов железа, предохраняющей металл от дальнейшего окисления.
Теоретический и практический интерес представляет исследование пассивирования стали в растворах солей нитроаромати-ческих кислот и сохранения пассивного состояния после измене-ния внешних пассивирующих условий.
Исследовано влияние природы анионов нитроароматических кислот на пассивирование стали и сохранение пассивного состояния при изменении внешних условий.
При использовании вяжущих с пониженной способностью к пассивированию стали, а также легких песков, связывающих гидроокись кальция, плотность и толщина защитного слоя бетона у арматуры приобретают решающее значение. Это объясняется тем, что при неустойчивом состоянии пассивности стали коррозия начинает развиваться при весьма небольшом преобладании активирующих веществ у ее поверхности, задержать поступление которых может только слой бетона необходимой плотности и толщины.
Цементы на основе клинкера ( портландцемент, пуц; цолановый портландцемент, шлакопортландцемент) обеГ — спечивают щелочность межфазной жидкости в бетоне, достаточную для пассивирования стали. Однако бетоны на последних двух цементах быстрее карбонизируются и раньше, чем бетон на портландцементе, теряют способность пассивировать арматуру.
Через трое суток после анодной поляризации при ширине трещин 0 2 мм и менее произошло восстановление первоначальной потенциала ( рис. 6), что объясняется пассивированием стали даже при наличии в окружающем электролите хлор-ионов. Прк широких трещинах произошло необратимое нарушение пассивности стали и потенциал установился на более отрицательном уровне, приблизительно равном — 500 мв.
Однако, рассматривая многочисленное семейство современных бетонов, отличающихся разнообразием вяжущих, заполнителей и добавок, а также различными режимами твердения, можно установить, что многие из этих бетонов не в состоянии обеспечить первоначальное пассивирование стали, другие быстро теряют пассивирующую способность под воздействием среды.
Приготовление растворов: — хроматирования цинковых и кадмиевых покрытий, — травления меди и ее сплавов, — выщелачивания магниевых сплавов, — удаления недоброкачественных медных, никелевых, кадмиевых, анодноокисных и фосфатных покрытий, — снятия травильного шлама, — пассивирования меди, — пассивирования цинковых сплавов, — пассивирования сталей, — наполнения фосфатного покрытия сталей.
Все способы пассивирования стали, кроме обработки в серной кислоте, снижают адгезионную прочность цинковых покрытий. Если без пассивирования адгезионная прочность цинковых покрытий к стали составляет 2 5 X X 103 Дж / ма , то в результате пассивирования растворами КМп04, К2Сг207 и K2Cr20 j адгезионная прочность снижается и составлет соответственно 1 65; 1 50 и 1 07 — 103 Дж / ма. В то время как для цинковых пленок пассивирование стали снижает их адгезионную прочность, для медных пленок пассивирование стали действует на их адгезионную прочность двояко: либо уменьшает, либо увеличивает ее.
Страницы: 1 2
www.ngpedia.ru
Пассивирование
Пассивирование,
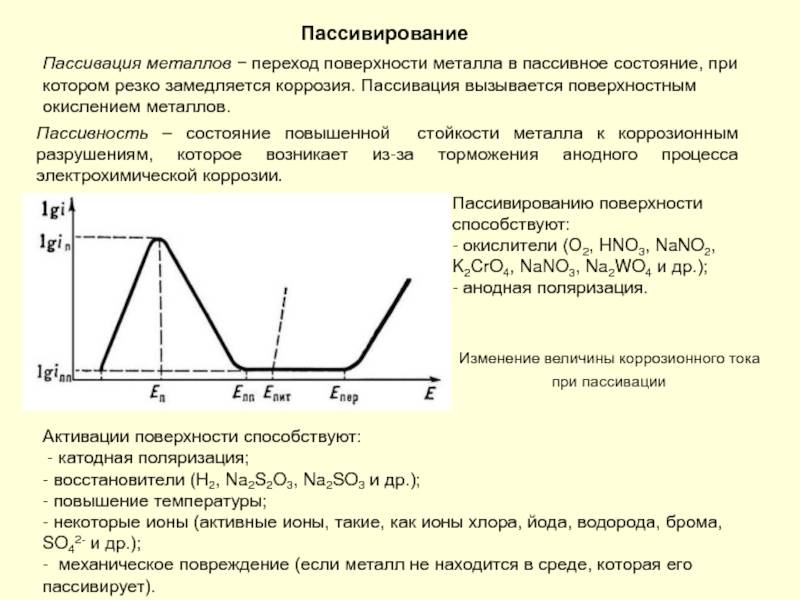
пассивация металлов, переход поверхности металла в пассивное состояние, при котором резко замедляется коррозия. Пассивирование вызывается поверхностным окислением металлов. Практическое значение пассивирования исключительно велико, так как все конструкционные металлы без их самопроизвольного пассивирования подвергались бы быстрой коррозии не только в агрессивных химических средах, но и во влажной земной атмосфере или пресной воде.
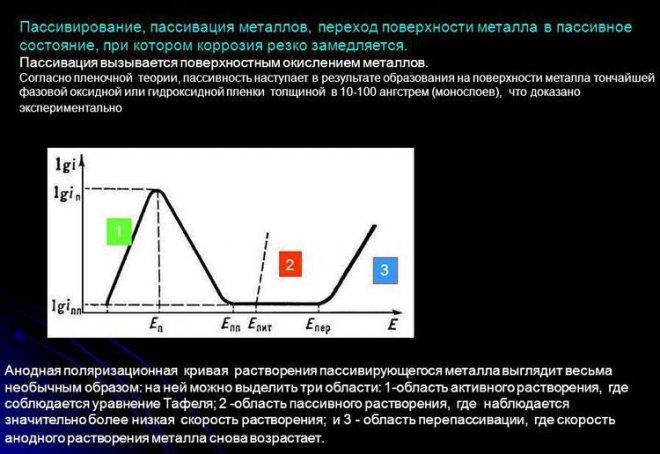
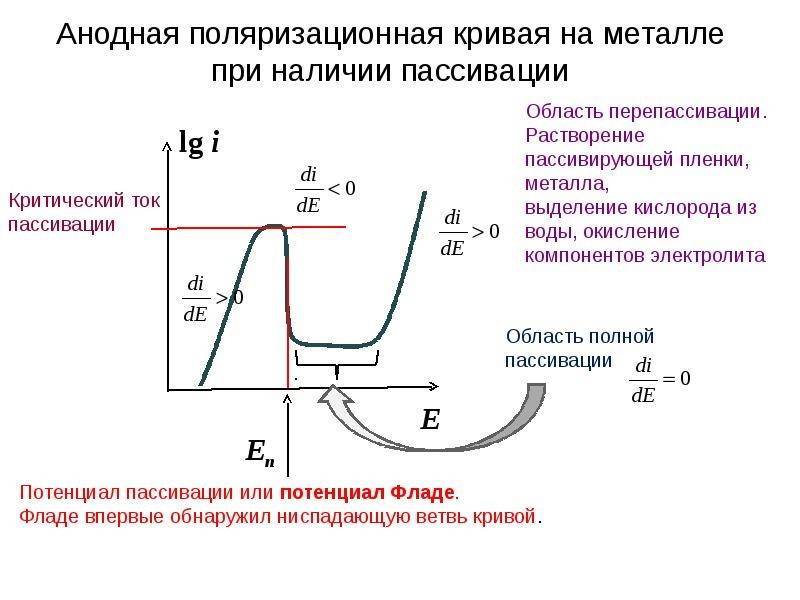
Если погрузить металл, склонный к пассивированию, в неокислительный водный раствор электролита, подключить его к источнику тока, позволяющему задавать любые значения потенциала (так называемому потенциостату) и записать зависимость плотности тока растворения металла от задаваемого потенциала, то получится поляризационная кривая, близкая к представленной на рисунке. Кривая показывает, что пассивирование металла начинается при потенциале пассивации Еп и критической плотности тока iп. С увеличением потенциала от Еп до Епп (потенциала полной пассивации) плотность тока не увеличивается, а снижается в результате пассивирования иногда в 104—105 раз (до iпп) и далее сохраняется почти без изменений вплоть до потенциала перепассивации Епер.
Наблюдаемое затем новое ускорение растворения связывают с перепассивацией, или транспассивным состоянием. Интервал от Епп до Епер называют областью пассивного состояния. В присутствии ионов Cl-, Br-, I- местное сильное растворение («питтинг») некоторых пассивных металлов начинается ещё при потенциале Епит < Епер.
Все перечисленные величины являются важными характеристиками поведения металлов и при коррозии под действием окислителей. Так, металл коррелирует с минимальной скоростью (эквивалентной плотности тока в полностью пассивном состоянии iпп) тогда, когда окислительно-восстановительный потенциал среды Ео-в удовлетворяет условию Епп < Ео-в < Епер. Для того чтобы пассивирование было самопроизвольным (при отсутствии внешних источников тока), скорость восстановления окислителя при Еп должна быть не меньше iп. Например, разбавленные растворы азотной кислоты в отношении хрома удовлетворяют обоим этим условиям, а в отношении железа —только первому. Соответственно Cr в них пассивируется сам, a Fe только может сохранять пассивное состояние, созданное каким-то способом ранее. Поскольку для Cr iп и iпп в сотни раз меньше, чем для Fe, а Епп и Епер — на 0,4—0,5 в отрицательнее, Cr несравненно устойчивее Fe в слабо окислительных средах, но вследствие перепассивации значительно сильнее разрушается в сильных окислителях (дымящей азотной кислоте, кислотах с добавками перманганатов, хроматов и др.). Сильное повышение концентрации кислоты или щёлочи обычно ведёт к увеличению iп и iпп, и в таких средах устойчивы лишь некоторые металлы. Среди них наибольшее значение имеют Cr, Ni и богатые ими сплавы, Ti, Zr. В нейтральных средах к пассивированию в той или иной мере склонна большая часть металлов. В неводных растворах пассивирование часто оказывается возможным только в присутствии влаги. В теории пассивирования важная роль отводится как адсорбции кислорода, так и образованию окисных слоев.
Перепассивация вызывается образованием высших кислородных соединений металла, которые либо растворяются целиком, давая анионы (CrO42-), либо отдают в раствор свои катионы, распадаясь с выделением кислорода (NiO2). Источниками кислорода, участвующего в образовании пассивирующих слоев, могут быть некоторые окислители (H2O2, HNO3). Пассивированию могут способствовать анионы, дающие с металлом труднорастворимые соли или смешанные окислы. Однако наиболее универсальным источником пассивирующего кислорода является химически или электрохимически взаимодействующая с металлом вода.
В технике термин «пассивирование» означает также специальную химическую или электрохимическую обработку металла в подходящем растворителе, повышающую стойкость его исходного пассивного состояния (пассивирование алюминиевой посуды в 30%-ной HNO3, цинковых покрытий в хроматных растворах и т.д.). Вещества, главным образом окислители, с помощью которых производится пассивирование, называются пассиваторами.
Лит.: Томашов Н. Д., Чернова Г. П., Пассивность и защита металлов от коррозии, М., 1965; Скорчеллетти В. В., Теоретические основы коррозии металлов, Л., 1973; Новаковский В. М., Обоснование и начальные элементы электрохимической теории растворения окислов и пассивных металлов, в сборнике: Коррозия и защита от коррозии, т. 2, М., 1973.
В. М. Новаковский.
Рис. к ст. Пассивирование.
Виды пассивации
Основными и наиболее хорошо отработанными видами пассивации являются:
- химическая;
- электрохимическая.
Химическая
Химическая пассивацияпредполагает применение растворов солей различных металлов.Наиболее эффективно пассивация производится азотной кислотой. Кроме неё для формирования раствора пользуются серной кислотой или лимонной. Для повышения качества процесса в раствор добавляют небольшое количество бихромата натрия. Его количество не превышает 6% от общей массы. Состав раствора подбирается индивидуально и во многом зависит от марки обрабатываемого металла. Например, для пассивации железа применяют соли металлов, растворённые в серной кислоте высокой концентрации.
Сущность химической пассивации заключается в активном притяжении отрицательных ионов, которые присутствуют в растворе, к атомам металла.Это происходит благодаря наличию у них положительного заряда. В результате такой диффузии образуется поверхностный слой.
Для пассивации обязательно проводят предварительную подготовку поверхности изделия. Её тщательно зачищают механическими и химическими методами.От качества этой процедуры зависит конечный результат и надёжность образованной плёнки.Большое значение это имеет при пассивации цветных металлов: латуни, меди, бронзы.
Электрохимическая
Этот вид пассивации основан на принципах, заложенных в технике гальванической обработки изделий. Ускорение обработки осуществляется благодаря воздействию постоянного тока, который протекает через раствор, ускоряя химическую реакцию. Такая пассивация называется электрохимическая.
В состав такой установки кроме ванны, в котором размещают электролит, используется источник постоянного тока, соединительные провода и один электрод. Вторым электродом является сама деталь.Другим вариантом контактов являются один электрод и корпус ванной (она должна быть изготовлена из металла, стойкого к воздействию электролита и электрического тока). На практике применяют электрические установки с относительно невысоким уровнем напряжения. Его величина не превышает 12В.
В обоих случаях при включении установки через раствор пропускают электрический ток. Он является стимулятором протекания процесса пассивации на поверхности заготовки. На практике различаю анодную и катодную пассивацию.
При такой пассивации положительный потенциал подается на заготовку, а отрицательный — на корпус ванны. При использовании электрохимического способа защитная пленка образуется быстрее и получается более ровной. Но такая технология дороже химической пассивации, т. к. в ней применяется более сложное оборудование и происходит расход электроэнергии.Под его действием защитная пленка получается равномерной. Именно так формируется плёнка на поверхности медных заготовок. Ток пропускают через растворы с растворёнными в них солями хрома. Именно в них медь приобретает наибольшую стойкость к коррозии.
Важными параметрами в этом процессе является время протекания пассивации, плотность и состав электролита, критическая величина тока пассивации. Эти параметры рассчитаны для различных металлов и приведены в специальных таблицах. На основании этих данных рассчитывают допустимое время обработки.