Слайды и текст этой презентации
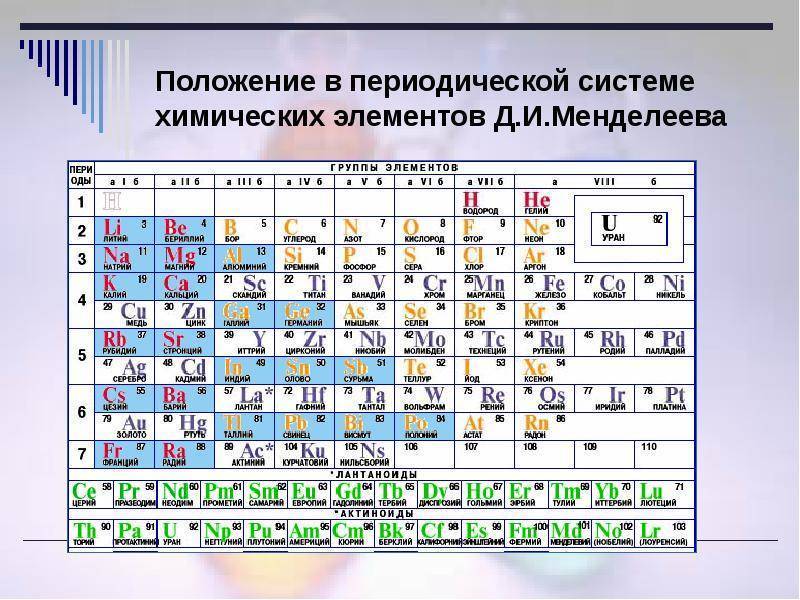
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
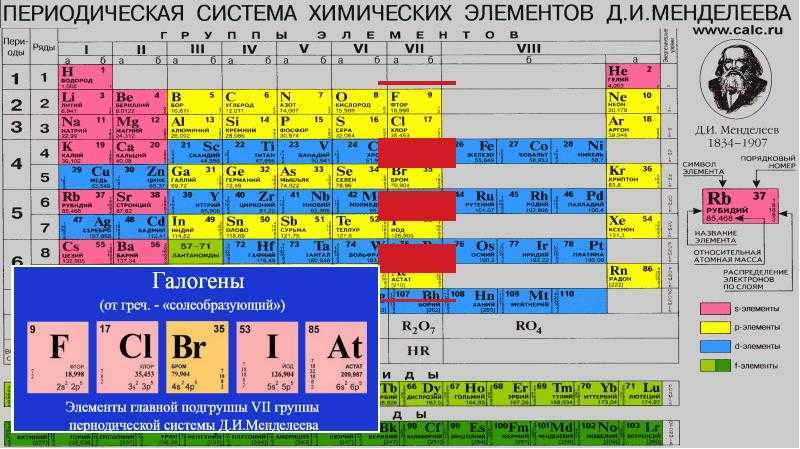
Длительное время положение водорода в периодической системе элементов было двойственным – его размещали и в 1-й, и в 7-й группах, но по последним рекомендациям ИЮПАК водород – элемент группы № 1.
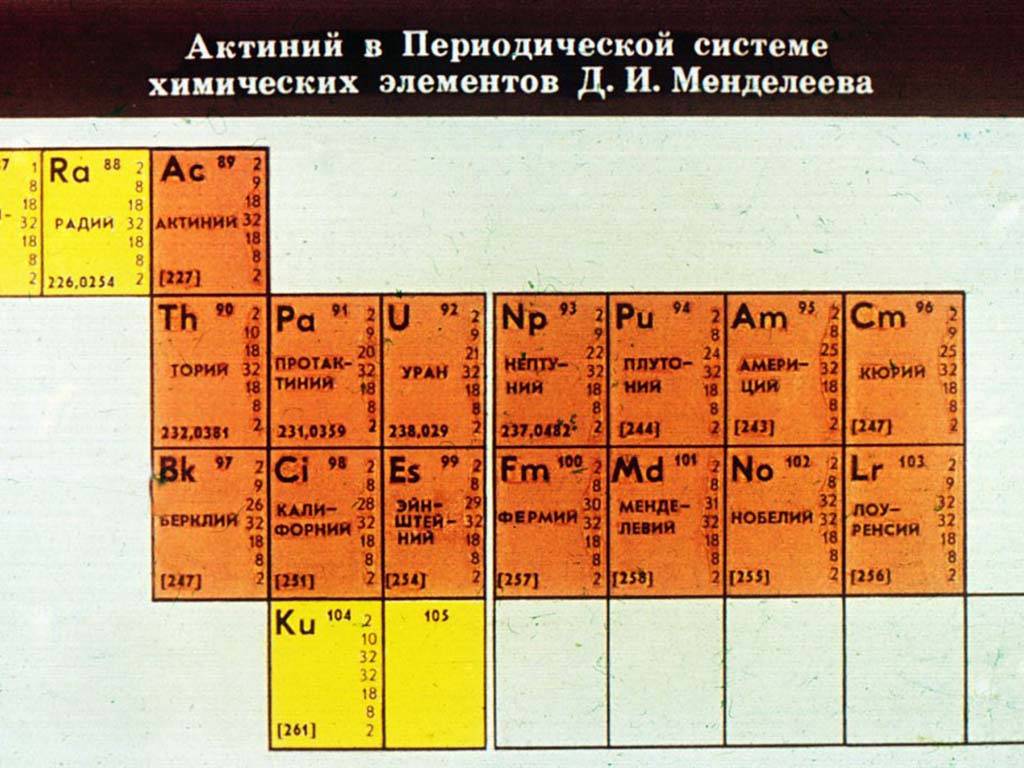
Торий (Th) № 90 (назван по имени Тора — скандинавского бога войны) — тяжёлый слаборадиоактивный; чистый металл мягок и пластичен, но сплавы могут быть очень твердыми, например, с Mg. Используется в светопреломляющих материалах, ядерных топливных элементах, непроницаемых для газов оболочках.Протактиний (Ра) № 91 (от греческого protos — первый) — содержится в урановом ядерном топливе, в промышленности применяется мало.Уран (U) № 92 (назван в честь планеты Уран) — ковкий, пластичный металл. Используется как ядерное топливо в реакторах, а изотоп 235U — для создания ядерного оружия.
История синтеза сверхтяжелых элементов
В 1940-1953 годах профессором Гленом Сиборгом и его коллегами в Радиационной национальной лаборатории (Беркли, США) были синтезированы искусственные элементы с Z=93-100. Они были получены в реакциях последовательного захвата нейтронов ядрами изотопа урана 235U в длительных облучениях на мощных ядерных реакторах. Элемент с Z=101 (менделевий) был открыт в 1955 году при облучении эйнштейния ускоренными aльфа-частицами. В России в 1957 году для синтеза новых элементов была создана специальная лаборатория в Дубне, которую возглавил член-корреспондент Академии наук СССР Георгий Николаевич Флеров.
С 1960-х годов началась эпоха ускорителей элементарных частиц – циклотронов, эпоха ускорения тяжелых ионов, когда синтез новых элементов стали производить только при взаимодействии двух тяжелых ядер. Пять элементов с Z>101 были получены на ускорителях заряженных частиц (циклотрон Объединенного института ядерных исследований (ОИЯИ; Дубна, СССР) и линейный ускоритель тяжелых ионов “Хайлак” (Беркли, США) в ядерных реакциях с ускоренными тяжелыми ионами. Элементы с атомными номерами, начиная с 105, являются сверхтяжелыми искусственно полученными радиоактивными химическими элементами. Элементы с атомными номерами 104 и далее называются трансактинидными.
104-й элемент был впервые синтезирован в Дубне в 1964 году. Его получила группа ученых Лаборатории ядерных реакций во главе с Флеровым. В 1969 году элемент был получен группой ученых в университете Беркли, Калифорния. В 1997 году элемент получил название резерфордий, символ Rf. 105-й элемент был синтезирован в 1970 году двумя независимыми группами исследователей в Дубне и Беркли (США). Получил название дубний в честь города Дубна, где располагается Объединенный институт ядерных исследований, символ Db. Впервые 106-й элемент был получен в СССР Флеровым с сотрудниками в 1974 году, практически одновременно он был синтезирован в США Гленом Сиборгом с коллегами. В 1997 году Международный союз теоретической и прикладной химии (ИЮПАК) утвердил для 106 элемента название сиборгий (в честь Сиборга), символ Sg.
110-й элемент был открыт в 1994 году в Центре исследований тяжелых ионов в Дармштатде (ФРГ) в ходе эксперимента по напылению на пластины специального сплава, содержащего свинец, и его бомбардировки изотопами никеля. Назван дармштадтий в честь города Дармштадт (Германия), где был обнаружен. Символ Ds. 111-й элемент тоже был открыт в Германии, получил название рентгений (химический символ Rg) в честь германского ученого Вильгельма-Конрада Рентгена. 112-й элемент представляет собой трансурановый элемент, полученный при бомбардировке свинцовой мишени ядрами цинка. Период его полураспада составляет около 34 сек. Элемент был впервые получен в феврале 1996 года на ускорителе тяжелых ионов в Дармштадте.
Последний успешный эксперимент по синтезу нового сверхтяжелого элемента был проведен в Лаборатории имени Флерова Объединенного института ядерных исследований в 2010 году, был получен 117-й элемент таблицы Менделеева (Унунсептий). В апреле 2011 года физики из немецкого Центра исследования тяжелых ионов (GSI) в Дармштадте (Гессен) при участии российских коллег начали эксперимент по синтезу нового химического элемента с атомным номером 120.
Имя прилагательное 3 класс конспект логопедического занятия
Биология 7 класс латюшин параграф 18 конспект
Конспект занятия по развитию речи в средней группе на тему день защитника отечества
Организация пассажирских перевозок на железнодорожном транспорте конспект
- Конспект занятия определение на ощупь величины предмета
Нахождение в природе
С точки зрения нахождения в природе лантаноиды делятся на 2 группы: цериевую ( Ce, Pr, Nd, Pm, Sm, Eu) и иттриевую ( Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Данный раздел основывается на том, что в одних минералах встречаются преимущественно церий и его «группа», а в других — иттрий вместе с остальными элементами. К минералам цериевой группы относится монацит (Это, La, Nb ….) PO 4. Он образует россыпи монацитового песка, куда, кроме него, входит кварц, рутил, оксид тория. В монацитового песка содержатся все минералы цериевой группы. Элементы этой же группы содержатся в изоморфных фторокарбонатах (Это, La ….) FCO 3 (бастнезит), а также в собственном силикате Ce 2 Si 2 O 7 (церит). К минералам иттриевой группе относится ксенотим (Y, Eu, Gd, …) РО 4, в котором лантаноиды изоморфно замещают друг друга.
Второй по важности редкоземельный минерал — бастнезит — во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего ярко-желтый). Но химически с монацита его объединяет только большое содержание лантана и лантаноидов
Если монацит — фосфат, то бастнезит — фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов
Но химически с монацита его объединяет только большое содержание лантана и лантаноидов. Если монацит — фосфат, то бастнезит — фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов.
Есть даже селективный неодимовый минерал — ешинит. В этот минерал входят окислы кальция, тория, тантала, ниобия, иттрия, лантана и лантаноидов, из которых в нем больше церия и неодима.
Лантаноиды распространены в природе не одинаково. Наиболее труднодоступные лантаноиды — тербий, тулий, лютеций (все это лантаноиды с нечетными атомными номерами) — стоят дороже золота и платины.
Ресурсы лантанидов довольно значительны — суммарный массовое содержание лантанидов (вместе с лантаном) в земной коре 0,01%, что близко к содержанию меди. Наиболее распространенными являются La, Ce i Nd. Известно более 250 минералов, содержащих лантаниды. Из них собственных минералов лантанидов — 60-65 (содержание редких земель более 5-8%). Это главным образом фосфаты, лития или флуорокарбонаты, титанониобаты. Важнейшие минералы, содержащие лантаниды: монацит, ксенотим, бастнезит, гадолинит, ортит, лопарит, евксенит, фергусонит, самарскит. Лантаниды концентрируются в различных типах магматогенных, осадочных и метаморфогенных месторождений.
В Украину руды лантанидов не добываются. Потребности страны (ок. 100 т / год) покрывает импорт. Промышленные концентрации лантанидов обнаружены в юго-восточной и юго-западной частях Украинского щита.
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях, которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно, чем кобальт, то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный, чем серебро, и туллий более обильный, чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса, согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
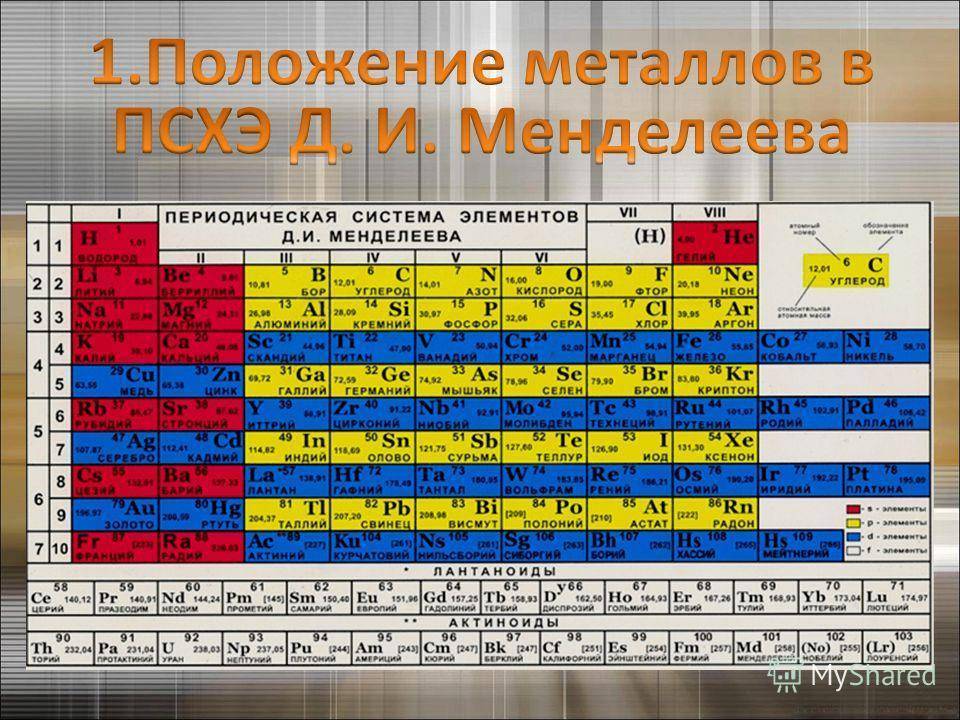
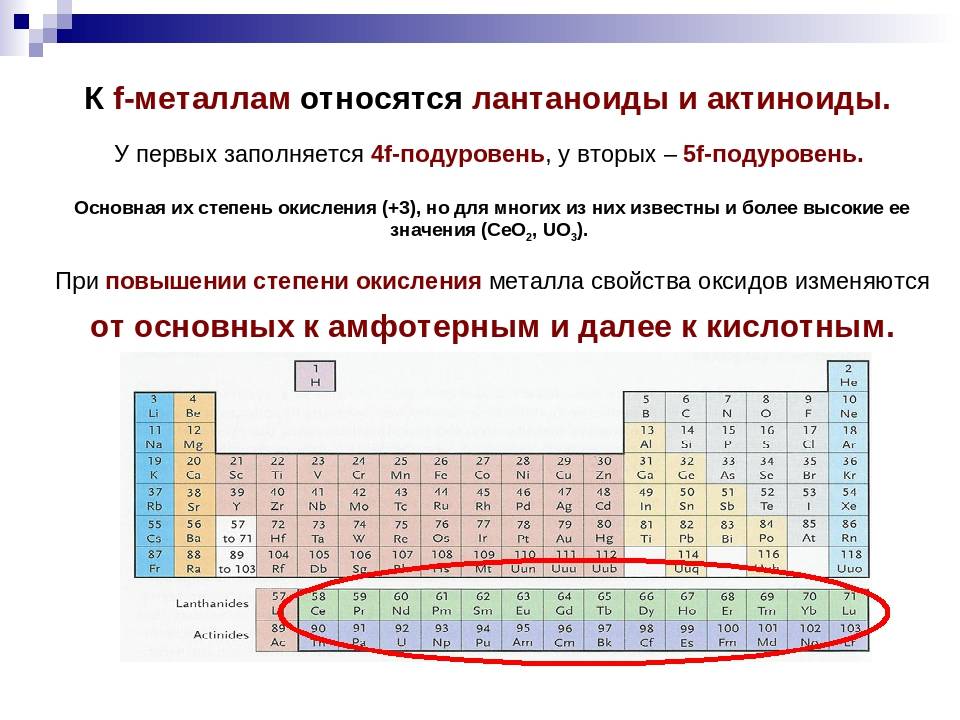
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
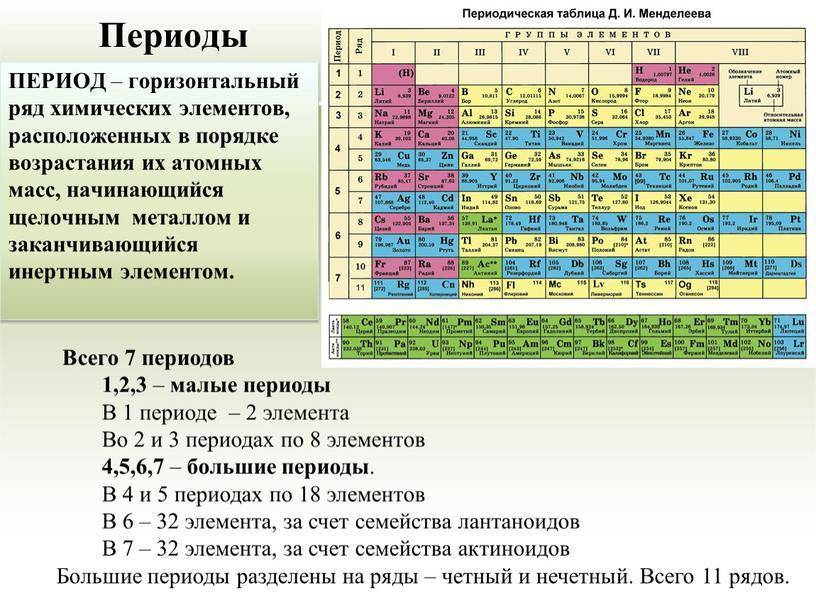
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
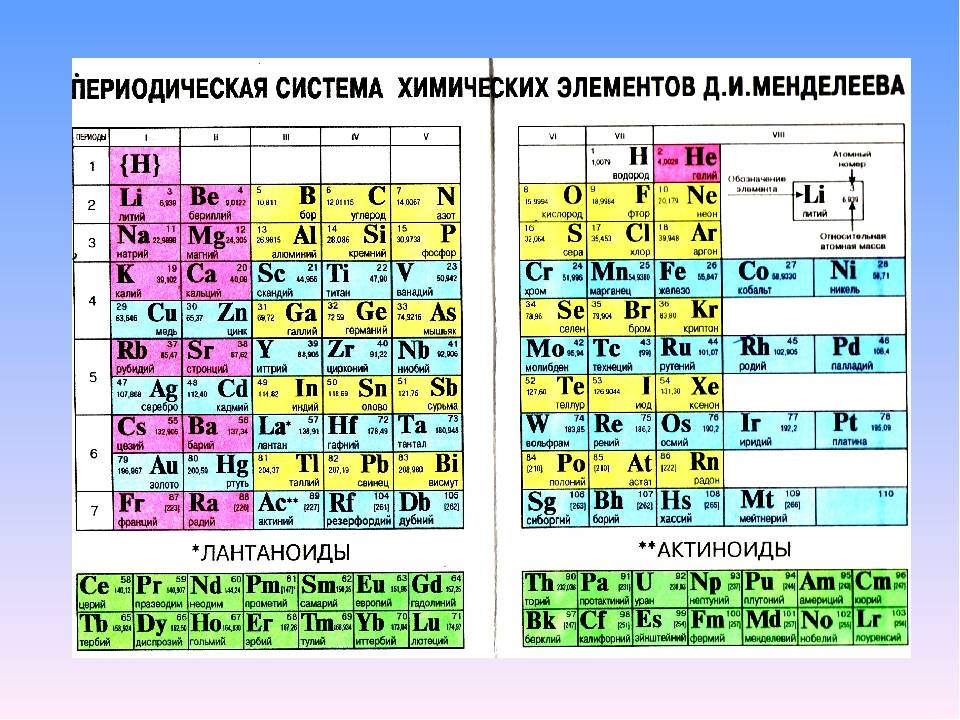
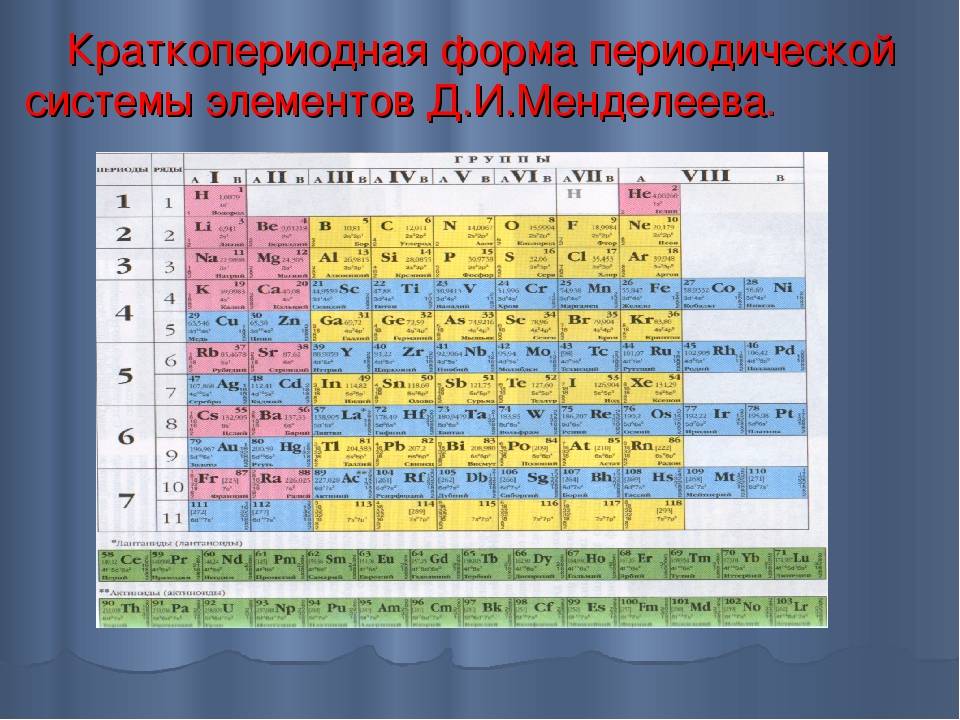
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
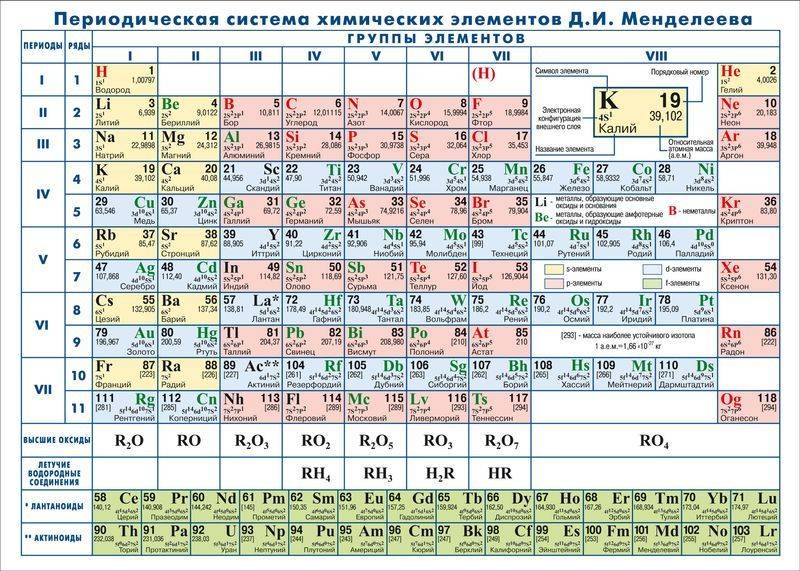 Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
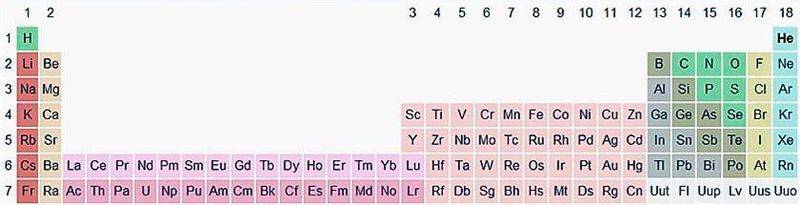 Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Характерные химические реакции (adsbygoogle = window.adsbygoogle || []).push({});
Как было отмечено ранее, лантаноиды и актиноиды являются химически активными металлами. Так, лантан, церий и другие элементы семейства легко соединяются с простыми веществами – галогенами, а также с фосфором, углеродом. Лантаноиды могут также взаимодействовать как с монооксидом углерода, так и с углекислым газом. Они также способны разлагать воду. Кроме простых солей, например таких как SeCl3 или PrF3, они образуют двойные соли
В аналитической химии важное место занимают реакции металлов-лантаноидов с аминоуксусной и лимонной кислотами. Образующиеся в результате таких процессов комплексные соединения применяются для разделения смеси лантаноидов, например в рудах. При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли
Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография
При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография.
У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.
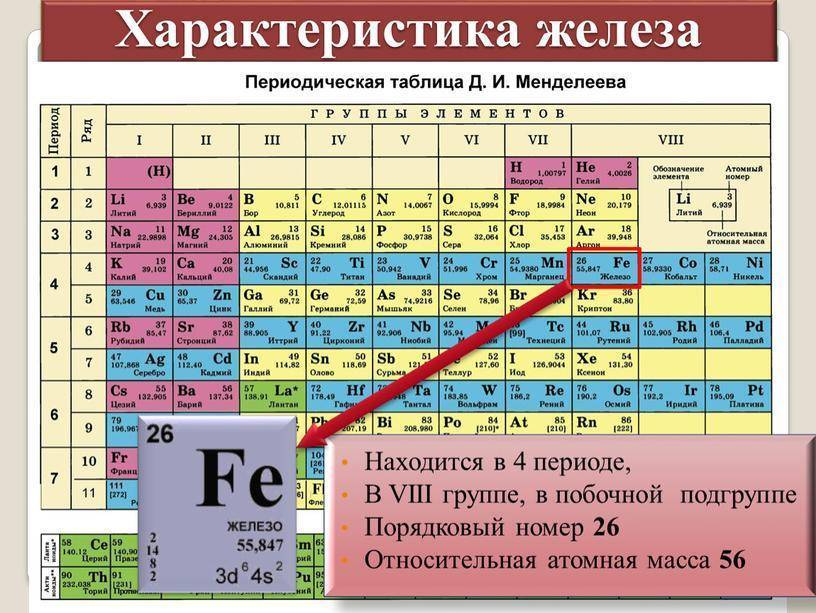
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать – это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
ВаO + SO3 → ВаSO4
Ва(ОН)2 + SO3 → ВаSO4 + H2O
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
SrO + H2SO4→ SrSO4 + H2O
Sr(OH)2 + H2SO4 → SrSO4 + 2H2O
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
История
Карл Густав Мосандер, первооткрыватель лантана
В 1751 году шведский минералог Аксель Фредрик Кронштедт обнаружил тяжелый минерал из шахты на Bastnäs, позже названный церит. Тридцать лет спустя пятнадцатилетний Вильгельм Хисингерот семьи, владеющей шахтой, отправил образец Карл Шееле, который не нашел внутри никаких новых элементов. В 1803 году, после того как Хизингер стал мастером по производству железа, он вернулся к минералу с Йенс Якоб Берцелиус и выделили новый оксид, который они назвали церия после карликовая планета Церера, который был обнаружен двумя годами ранее. Церия была одновременно независимо изолирована в Германии Мартин Генрих Клапрот. Между 1839 и 1843 годами шведский хирург и химик показал, что церий представляет собой смесь оксидов. Карл Густав Мосандер, который жил в том же доме, что и Берцелиус: он выделил два других оксида, которые назвал лантана и дидимия. Он частично разложил образец нитрат церия запеканием на воздухе и последующей обработкой полученного оксида разбавленным азотная кислота. В том же году Аксель Эрдманн, студент Каролинского института, обнаружил лантан в новом минерале с острова Ловен, расположенного в норвежском фьорде.
Наконец, Мосандер объяснил свое промедление, сказав, что он извлек из церия второй элемент, который он назвал дидимием. Хотя он и не осознавал этого, дидим тоже был смесью, и в 1885 году его разделили на празеодим и неодим.
Поскольку свойства лантана мало отличались от свойств церия и присутствовали вместе с ним в его солях, он назвал его от Древнегреческий λανθάνειν (букв. скрывать). Относительно чистый металлический лантан был впервые выделен в 1923 году.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.