Основные свойства алюминия
Главными факторами, определяющими обширность использования любого материла, являются его свойства и показатели. На сегодняшний день Сплавы на основе алюминия применяются практически во всех сферах деятельности. Простой причиной для такого распространения служат основные свойства алюминия, которые приведены в списке.
- плотность — 2,7 г/см³
- температура плавления технического алюминия — 658 °C;
- температура плавления чистого алюминия — 660 °C;
- удельная теплота плавления— 390 кДж/кг;
- температура кипения — 2500 °C;
- удельная теплота испарения— 10,53 МДж/кг;
- удельная теплоемкость— 880 Дж/кг·K;
- временное сопротивление литого алюминия — 10—12 кг/мм², временное сопротивление деформируемого — 18—25 кг/мм²,временное сопротивление сплавов — 38—42 кг/мм²;
- Твёрдость по Бринеллю — 24…32 кгс/мм²;
- пластичность у технического — 35 %;
- пластичность у чистого — 50 %;
- Модуль Юнга— 70 ГПа;
- Алюминий обладает высокой электропроводностью (37·106 См/м) и теплопроводностью (203,5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражающей способностью;
- Слабый парамагнетик;
- Температурный коэффициент линейного расширения 24,58·10−6К−1 (20…200 °C);
- Удельное сопротивление 0,0262..0,0295 Ом·мм²/м;
- Температурный коэффициент электрического сопротивления 4,3·10−3K−1. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
Важным свойством, которым отличаются сплавы на основе алюминия — это высокая пластичность
Легко может раскатываться в фольгу, что особенно важно для использования в электронике и электротехнике. Материал легко может обрабатываться при небольших механических усилиях
Невысокая температура плавления позволяет переплавлять и изготавливать детали из сплавов алюминия с минимальными энергетическими затратами, что удешевляет производство и саму продукцию
Невысокая температура плавления позволяет переплавлять и изготавливать детали из сплавов алюминия с минимальными энергетическими затратами, что удешевляет производство и саму продукцию.
Марки алюминия по ГОСТУ
Алюминий и его сплавы, равно как и другие металлы, маркируется по установленным стандартам. Так, существуют марки алюминия по ГОСТУ, которые приведены в списках.
Деформируемые алюминиевые сплавы:
Упрочняемые термической обработкой:
- Дюраль Д1, Д16, Д20*, сплавы алюминия меди и марганца ;
- Сплав авиаль (АВ);
- Высокопрочный сплав (В95);
- Сплавы для ковки и штамповки (АК6, АК8, АК4-1 ).
Не упрочняемые термической обработкой:
- Сплавы алюминия с марганцем (АМц);
- Сплавы алюминия с магнием (АМг2, АМг3, АМг5, АМг6).
Литейные алюминиевые сплавы для фасонного литья:
- Сплавы алюминия с кремнием (силумин /) Al-Si (АЛ2, АЛ4, АЛ9) — высокая плотность отливок, легко обрабатываются резанием, отличаются высокими линейными показателями;
- Сплавы алюминия с медью Al-Cu (АЛ7, АЛ19) — высокие механические свойства после термической обработки, легко обрабатываются резанием;
- Сплавы алюминия с магнием Al-Mg (АЛ8, АЛ27) — повышенная стойкость к коррозии, повышенные механические свойства, легко обрабатывается резанием;
- Жаропрочные алюминиевые сплавы (АЛ1, АЛ21, АЛ33) — легко обрабатываются резанием, повышенная жаропрочность.
Классификация с точки зрения удобства механической обработки (Мягкие и пластичные, неудобные для механической обработки резанием):
- Отожженные — Д16, АВ;
- Не упрочняемые термической обработкой — АМц, АМг2, АМг3, АМг5, АМг6.
Относительно прочные и твердые сплавы алюминия, которые достаточно легко обрабатывать механическим путем:
- Закаленные и искусственно состаренные: Д16Т, Д16Н, АВТ;
- Ковочные: АК6, АК8, АК4-1;
- Литейные: АЛ2, АЛ4, АЛ9, АЛ8, АЛ27, АЛ1, АЛ21, АЛ33.
История открытия
 Но так как алюминий обладает высокой химической активностью, то в чистом виде он практически не встречается в природе, поэтому в отличие от многих других металлов о нём стало известно только в начале XIX века, когда алюминий был формально получен.
Но так как алюминий обладает высокой химической активностью, то в чистом виде он практически не встречается в природе, поэтому в отличие от многих других металлов о нём стало известно только в начале XIX века, когда алюминий был формально получен.
В 1824 году датский физик в процессе электролиза впервые получил алюминий. Хотя металл и содержал примеси ртути и калия, этот случай является первым доказанным случаем получения алюминия в лабораторных условиях.
Имя учёного, привёдшего к революционному методу, было Ханс Кристиан Эрстед. Но понадобилось ещё почти полвека, чтобы разработать технологии для получения его в промышленном производстве. Больше всего природный алюминий встречается в составе минералов квасцов. Именно благодаря этому минералу алюминий и получил своё название, которое на латыни звучит Alumen.
[править] Источники
- Bassam Z. Shakhashiri. Chemical of the Week: Aluminum. Science is Fun
- Ludwig Darmstaedter; René Du Bois-Reymond, D. Carl Schaefer (1908). Handbuch zur geschichte der naturwissenschaften und der technik: In chronologischer darstellung. J. Springer. с. 43.
- Сент-Клер Девиль
- Колодин Э. А.; Свердлин В. А., Свобода Р. В. (1980). Производство обожженных анодов алюминиевых электролизеров. М.: Металлургия. с. 84.
- Кравчук П. А. Рекорды природы. — Любешов: Эрудит, 1993, 216 с.
- https://www.cmmarket.ru/markets/alworld.htm
- George E. Totten, D. Scott Mackenzie (2003). Handbook of Aluminum: Physical metallurgy and processes (англ.). CRC Press. с. 38.
- Клубович, Владимир Владимирович; Тявловский, Михаил Доминикович; Ланин, Владимир Леонидович (1985). Ультразвуковая пайка в радио- и приборостроении. Минск: Наука и техника.
- Виноградов Н. В. (1970). Производство электрических машин. Москва: Энергия. с. 244—246.
История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла — алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.

Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл — один из самых популярных и применяемых в строительстве и бытовой промышленности.
История открытия
Свое название серебристо-белый металл получил от латинского языка, в переводе оно означает квасцы. В 1825 году датский физик Ганс Эрстед нагрел амальгаму калия, восстановил хлорид вещества и выделил новый металл. Затем этот эксперимент повторил и улучшил Фридрих Велер. Он применил чистый металлический калий и первый описал химические особенности алюминия.

Полупромышленный способ выделения открыл Сент-Клер Девиль в 1854 году, но он использовал безопасный натрий. Полученный алюминиевый слиток ученый представил на Парижской выставке. А затем он провел еще один эксперимент — электролиз расплава двойной соли хлорида вещества.
До развития технологий алюминий, созданный электролитическим способом из глинозема, был слишком дорогим. Его слиток стоил больше, чем аналогичный кусок золота. Именно поэтому в 1889 году британские ученые подарили Менделееву аналитические весы. Чаши в них были изготовлены из разных металлов — золота и алюминия. В то время в России последнее вещество называли серебром из глины.
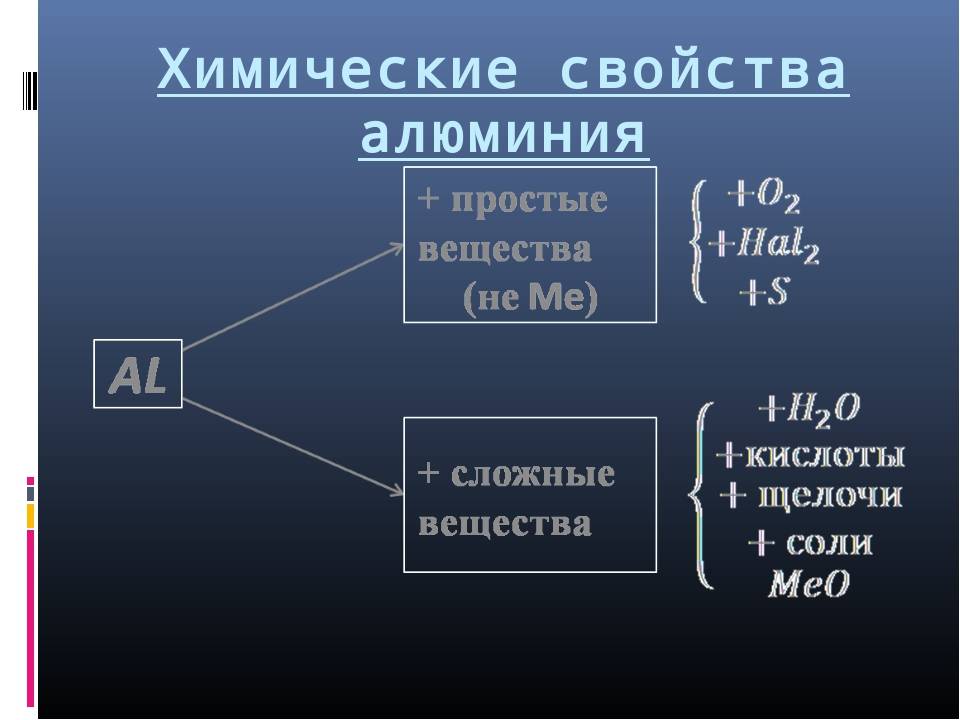
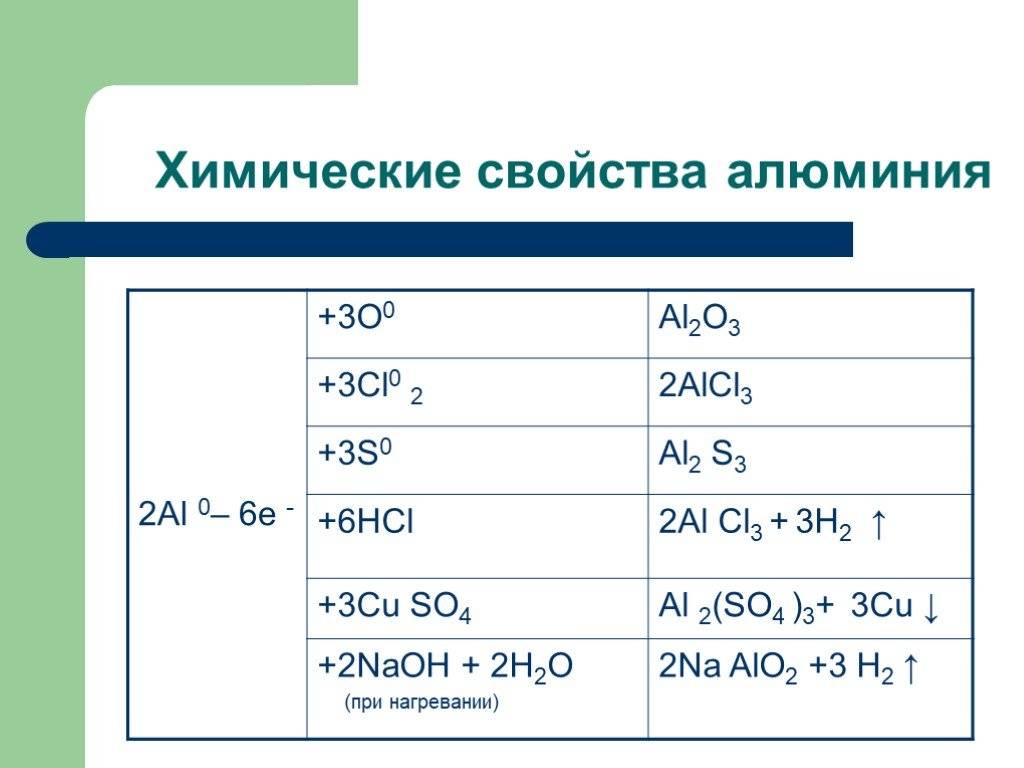
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl + 6Н+ = 2Аl3+ + 3H2;
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
Геохимия алюминия
Самый распространенный минерал алюминия — это его оксид Al2O3. В природе он встречается в разных минералах, из которых самый распространённый — боксит Al2O3 * xH2O:
 Боксит
Боксит
Включения других элементов в состав минерала делают его необычайно красивым. Прекрасные рубин, сапфир, топаз, аквамарин представляют из себя минералы, состоящие в основном из оксида алюминия, цвет которых обеспечивается за счет примесей — соединений хрома(II и III), железа, титана, марганца и многих других.
- Рубин
- Сапфир
- Топаз
 Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминий
Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминий
Вместе с кремнием алюминий образует группу самых распространённых в земной коре минералов. Их объединяют под общим названием — алюмосиликаты, подчёркивая наличие алюминия и кремния (silicium) в их составе.
 Аквамарин
Аквамарин
Физические свойства алюминия таблица – Справочник металлиста

Алюминий – металл, содержание которого в природе самое большое среди всех известных.
Позднее начало его применения вызвано тем, что, поскольку он обладает высокой химической активностью, то находится в земной коре только в составе различных химических соединений.
Восстановление чистого металла сопряжено с рядом трудностей, преодолеть которые стало возможным только с развитием технологий добычи металлов.
Внешний вид алюминия
Механические свойства алюминия, такие как мягкость, податливость штамповке, легкость в обработке, послужили широкому распространению во многих отраслях промышленности. Особенно часто алюминия используется в составе сплавов с другими металлами.
Физические и химические свойства сплавов алюминия послужили поводом к широкому использованию их в качестве конструкционных материалов, снижающих общий вес конструкции без ухудшения прочностных качеств.
Свойства алюминия и его сплавов
Алюминий является третьим по распространенности – после кислорода и кремния – среди около 90 химических элементов, который обнаружены в земной коре. Среди элементов-металлов – он первый. Этот металл обладает многими полезными свойствами, благодаря которым он широко применяется во всех сферах человеческой деятельности.
Алюминий – это ковкий металл, который имеет серебристо-белый цвет и легко обрабатывается большинством методов обработки металлов давлением: прокаткой, волочением, экструзией (прессованием), ковкой. Его плотность – удельный вес – составляет около 2,70 граммов на кубический сантиметр. Чистый алюминий плавится при температуре 660 градусов Цельсия.
Алюминий имеет относительно высокие коэффициенты теплопроводности и электропроводности. Этот металл в присутствии кислорода всегда покрыт тонкой, невидимой пленкой оксида. Эта пленка является в значительной степени непроницаемой и имеет довольно высокие защитные свойства. Поэтому алюминий обычно демонстрирует стабильность и длительный срок службы при нормальных атмосферных условиях.
Алюминий и драгоценные камни
Из-за его химической активности и высокому сродству к кислороду алюминий не встречается в природе в металлическом состоянии. Он всегда находится в комбинации с другими химическими элементами. Рубины и сапфиры, например, являются комбинациями – соединениями – алюминий и кислорода, гранаты – алюминия и кремния, а нефриты – это соединения алюминия с натрием, кислородом и кремнием.
Свойства алюминия
В чистом виде алюминий — металл серебристого белого цвета. Одно из важных свойств алюминия — его малая плотность: в твердом состоянии (при 20° С) она равна 2,7 г/см3, а в жидком виде (при 900° С) — 2,32 г/см3. Температура плавления высокочистого алюминия (99,996%) равна 660,24° С, температура кипения — 2500° С. Важными свойствами алюминия, определяющими его применение во многих областях промышленности, являются его хорошая электропроводность и теплопроводность.
Алюминий хорошо обрабатывается механически, обладает хорошей ковкостью, легко прокатывается в тончайший лист и проволоку. В химических реакциях алюминий амфотерен. Он растворяется в щелочах, соляной и серной кислотах, но стоек по отношению к концентрированной азотной и органическим кислотам. На внешней М-оболочке алюминия три валентных электрона, причем два — на 3s- орбите и один на 3p-орбите. Поэтому обычно в химических соединениях алюминий трехвалентен. Однако в ряде случаев алюминий может терять один p-электрон и проявлять себя одновалентным, образуя соединения низшей валентности.
Производство алюминия в настоящее время включает в себя две основные операции:
- получение безводной, свободной от сопутствующих алюминию примесей, окиси алюминия путем сложной химической переработки природных соединений (бокситов, глины, каолина);
- получение металлического алюминия методом электролиза глинозема, растворенного в криолите.
Алюминий обладает многими ценными свойствами: небольшой плотностью— около 2,7 г/см3, высокой теплопроводностью — около 300 Вт/(м • К) и высокой электропроводностью 13,8 • 107 Ом/м, хорошей пластичностью и достаточной механической прочностью.
Алюминий образует сплавы со многими элементами. В сплавах алюминий сохраняет свои свойства. В расплавленном состоянии алюминий жидкотекуч и хорошо заполняет формы, в твердом виде он хорошо деформируется и легко поддается резанию, пайке и сварке. Применяется в ремонтных работах — восстановлению деталей из алюминиевых сплавов, ремонт акпп — сварка корпуса, удаление трещин и тд.
Сродство алюминия к кислороду очень большое. При его окислении выделяется большое количество тепла (~ 1670000 Дж/моль). Тонкоизмельченный алюминий при нагревании воспламеняется и сгорает на воздухе. Алюминий соединяется с кислородом воздуха и в атмосферных условиях. При этом алюминий покрывается тонкой (толщиной ~ 0,0002 мм) плотной пленкой окиси алюминия, защищающей его от дальнейшего окисления; поэтому алюминий стоек против коррозии. Поверхность алюминия хорошо защищается от окисления этой пленкой и в расплавленном состоянии.
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком
Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии
При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Физические свойства алюминия зависят от его чистоты
Таблица физических свойств алюминия | |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99.97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Вред от принятия пищи из алюминиевой посуды
Отсекая огромный ворох страшилок об опасностях, связанных с алюминием, следует обратить внимание на официальное заявление Всемирной организации здоровья. Еще в 1998 году было сказано, чтобы нанести вред организму человека алюминием, его нужно принять внутрь более 50 мг одномоментно.. Для простого примера можно сказать, что даже кислые щи, простояв в алюминиевой кастрюле целую неделю, вбирают в себя не более 3 мг вещества
А поскольку вся окружающая человека среда имеет в своем составе алюминий, то он поступает в организм постоянно. Мало того. Он еще и вырабатывается организмом.
Для простого примера можно сказать, что даже кислые щи, простояв в алюминиевой кастрюле целую неделю, вбирают в себя не более 3 мг вещества. А поскольку вся окружающая человека среда имеет в своем составе алюминий, то он поступает в организм постоянно. Мало того. Он еще и вырабатывается организмом.
Но даже усиленный прием лекарств (содержащих алюминий) не может быть опасен. Если собрать все факторы воедино, то суточная норма вещества никогда не может быть превышена при естественном порядке. Для того, чтобы получить отравление алюминием вместе с пищей, в нее необходимо только добавить его в большом количестве намеренно.
В течение 20 лет с момента первого заявления, ВОЗ неоднократно выступала с различными докладами, пресекающими различные мифы. Одним из них выступает связь болезни Альцгеймера с принятием пищи из алюминиевой посуды. Медицинские исследования это не подтвердили.
Также оказались ложными и страхи, что алюминий является канцерогенным. Связь с раковыми болезнями никак не подтвердилась. И на сегодняшний момент алюминий считается не опасным для человека. Но даже если у кого-то остаются сомнения, то стоит вспомнить о защитных пленках, которыми покрывается посуда. Они вообще препятствуют контакту пищи с алюминием.
Вот нарушения защитного покрытия следует избегать тем, кто не может избавиться от страхов о токсичности алюминия. Чтобы сохранить свой покой, достаточно соблюдать несколько правил. Поскольку на оксидную пленку негативно действует кислота, то следует контролировать ее появление.
Например, не проводить сбор ягод в алюминиевую посуду. В их соке содержится кислота, которая разъест защитное покрытие. А по мере возрастания массы собранных ягод, давление заставит нижний слой выделить сок. И этого никак не избежать.
Если в алюминиевой кастрюле варились кислые щи, то по завершении процесса их лучше перелить в другую емкость. А посуду тщательно вымыть. Негативное действие на защитную пленку также оказывают соли и щелочи. Поэтому хранить продукты с большим содержанием данных элементов в алюминиевой таре нежелательно.

Приготовление варенья в алюминиевой кастрюлеИсточник posudaguide.ru