Примечания
- H. Ortner International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Архивировано из первоисточника 20 июня 2012. Проверено 26 сентября 2010.
- Michael Bauccio Refractory metals// ASM metals reference book/ American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 19939780871704788
- Wilson, J. W General Behaviour of Refractory Metals// Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624
- Joseph R. Davis Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444
- ↑ 12Borisenko, V. A . Investigation of the temperature dependence of the hardness of molybdenum in the range of 20—2500 °C//Журнал Soviet Powder Metallurgy and Metal Ceramics . — 1963. — С. 182. — DOI:10.1007/BF00775076
- Fathi, Habashi Historical Introduction to Refractory Metals//Журнал Mineral Processing and Extractive Metallurgy Review . — 2001. — С. 25—53. — DOI:10.1080/08827509808962488
- Schmid, Kalpakjian Creep// Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358
- Weroński, Andrzej; Hejwowski, Tadeusz Creep-Resisting Materials// Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265
- ↑ 12Erik Lassner, Wolf-Dieter Schubert Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532
- National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- Michael K. Harris Welding Health and Safety// Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287
- William L. Galvery, Frank M. Marlow Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517
- W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics .. ;
- P. Ramakrishnan Powder metallurgyfor Aerospace Applications// Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303
- Arora, Arran Tungsten Heavy Alloy For Defence Applications//Журнал Materials Technology . — 2004. — В. 19. — № 4. — С. 210—216.
- V. S. Moxson, F. H. Froes Fabricating sports equipment components via powder metallurgy//Журнал JOM . — 2001. — В. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z
- Robert E. Smallwood TZM Moly Alloy// ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 19849780803102033
- Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A . Corrosion Resistance of Molybdenum in Mercury//Журнал Protection of Metals . — 2003. — В. 39. — С. 374—376. — DOI:10.1023/A:1024903616630
- Gupta, C. K . Electric and Electronic Industry// Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580
- Michael J. Magyar Commodity Summary 2009:Molybdenum. United States Geological Survey. Архивировано из первоисточника 20 июня 2012. Проверено 26 сентября 2010.
- D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg Structure and properties of high energy, high rate consolidated molybdenum alloy TZM//Журнал Materials Science and Engineering: A . — 1988. — В. 102. — С. 25.
- Neikov Oleg D . Properties of Molybdenum and Molybdenum Alloys powder// Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220
- Joseph R. Davis Refractory Metalls and Alloys// ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969
- ↑ 12John Hebda Niobium alloys and high Temperature Applications//Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA ). — Companhia Brasileira de Metalurgia e Mineração, 2001.
- J. W. Wilson Rhenium// Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624
Применение
После открытия тугоплавкие материалы использовали только для транзисторов электроники и конденсаторов. Сфера применения расширилась только в середине XX века. В то время такие металлы стали использовать еще для изготовления станков, ракет, автомобилей, при самолетостроении.

Вольфрам считается самым тугоплавким материалом из всей категории, но его сфера применения ограничена из-за хладноломкости. То есть, делать из этого материала выдержит высокие нагрузки, но если она упадет с большой высоты, то моментально раскрошится на части.

Перечислим основные отрасли, где применяют металл:
- Благодаря пластичности из него выполняют нити накаливания для освещения, их ставят в кинескопы или вакуумные трубки.
- Подходит в качестве электрода во время аргонно-дуговой сварки.
- Выступает основой тяжелых сплавов. Из них делают противовесы, снаряды для оружия, пули и детали для ракет.
- Сплавы подходят для создания медицинских инструментов, танковой брони, деталей двигателей, защитных контейнеров для опасных веществ.
- Является нагревательным элементом в вакуумных печах сопротивления.
- Благодаря высокой плотности используется для защиты от излучения ионов. Выполненные из вольфрама детали более дешевые и эффективные, если сравнивать материал со свинцом.
- Для обработки металлоконструкций или в отрасли машиностроения используются материалы с карбидом вольфрама.
- В ядерной физике вольфроматы кальция или свинца применяют в качестве детекторов рентгеновского излучения.

Сплавы на основе вольфрама используются для бурения скважин, создания высокотемпературной смазки, с их помощью создают преобразователи, которые делают из тепла электричество. В промышленности на основе тугоплавкого материала выпускают электроды, проволоку, порошок, листы. Материал не имеет аналогов, поэтому вся выполненная из него продукция отличается уникальными физическими и химическими свойствами.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
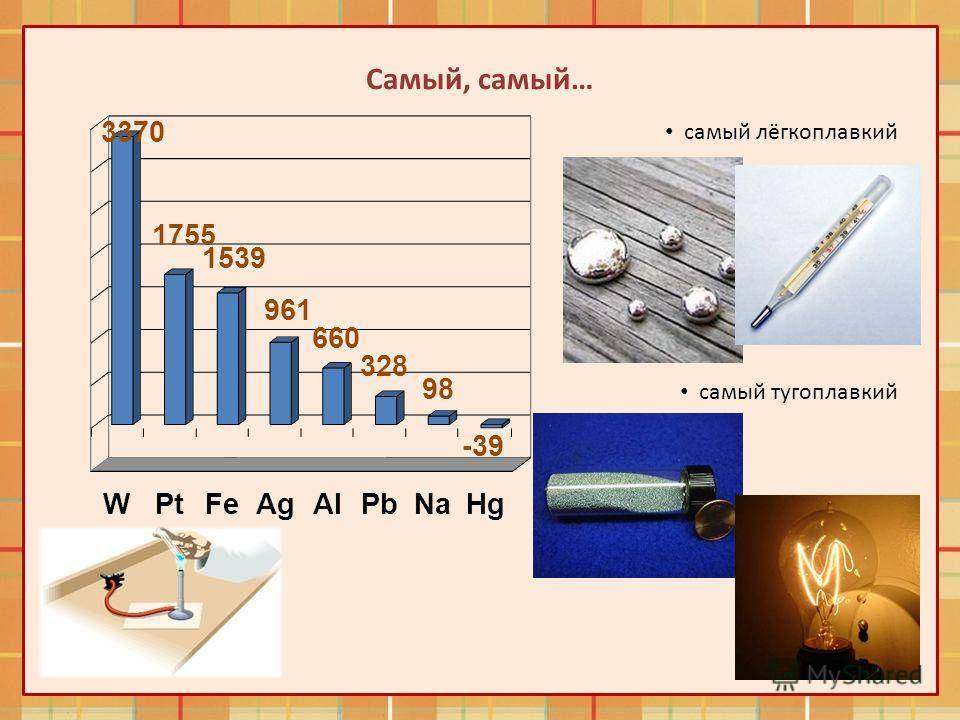
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Читать также: Резка металла из рулона
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Характеристики самого плотного металла
Ученые сошлись во мнении, что, несмотря на практически одинаковую плотность, иридий совсем чуть-чуть уступает самому тяжелому металлу. Однако полностью физико-химические свойства этих двух элементов пока не изучены.
Редкостью и трудозатратностью добычи обусловлена стоимость осмия – в среднем от $15 000 за грамм. Он внесен в группу платиновых и условно считается благородным, однако название металла противоречит статусу: по-гречески «осме» значит «запах». Из-за высокой химической активности осмий пахнет смесью чеснока или редьки с хлором.
Застывая из расплава, осмий образует красивые кристаллы с интересным сине- или серебристо-голубым отливом. Но, несмотря на красоту, для изготовления драгоценных аксессуаров он не подходит, так как не обладает свойствами, необходимыми ювелирам: ковкостью и пластичностью.
Элемент ценен только из-за особой прочности. Сплавы, в которые добавляют совсем малые дозы самого тяжелого металла, становятся невероятно износостойкими. Обычно им покрывают узлы, подвергающиеся постоянному трению.
История открытия
1803—1804 годы стали для самого тяжелого металла поворотными: именно в это время его открытие проходило практически в условиях соревнований.
Сначала английский химик Смитсон Теннант и его ассистент Уильям Хайд Уолластон, совершившие не одно важное открытие, обнаружили в процессе эксперимента с платиновыми рудами и азотной и соляной кислотами необычный осадок с характерным запахом и поделились своей находкой с другими. Далее эстафету перехватили французские ученые Антуан де Фуркруа и Луи-Николя Воклен и на основе предыдущих и своих собственных исследований заявили об обнаружении нового элемента. Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым
Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым
Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым
Далее эстафету перехватили французские ученые Антуан де Фуркруа и Луи-Николя Воклен и на основе предыдущих и своих собственных исследований заявили об обнаружении нового элемента. Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым.

Однако и Теннант не спал: он продолжал свои исследования и не упускал из виду опыты французов. В итоге Смитсон добился более конкретных результатов и в официальном документе, отправленном Лондонскому королевскому обществу, указал, что разделил птен на два родственных элемента: иридий («радуга») и осмий («запах»).
Где применяют
Список сфер применения довольно обширен: авиация, военная и ракетная техника, аэрокосмическая промышленность, медицина. Хотя производители оружия уже задумываются, чем можно заменить самый тяжелый в мире металл, так как осмий слишком трудно обрабатывать.
Почти половина мировых запасов самого тяжелого металла отдана на нужды химической промышленности. Им окрашивают живые ткани под микроскопом, обеспечивая их сохранность. Кроме того, его применяют как краситель при росписи фарфора.
Изотопы самого тяжелого металла используют для изготовления тары для хранения ядерных отходов.
Места природного залегания
В чистом виде осмий обнаружить практически нереально. Обычно этот тяжелый элемент встречается в соединении с иридием. Вещество содержится в месторождениях платиновых руд и на месте падения или в самих попавших на Землю метеоритах.
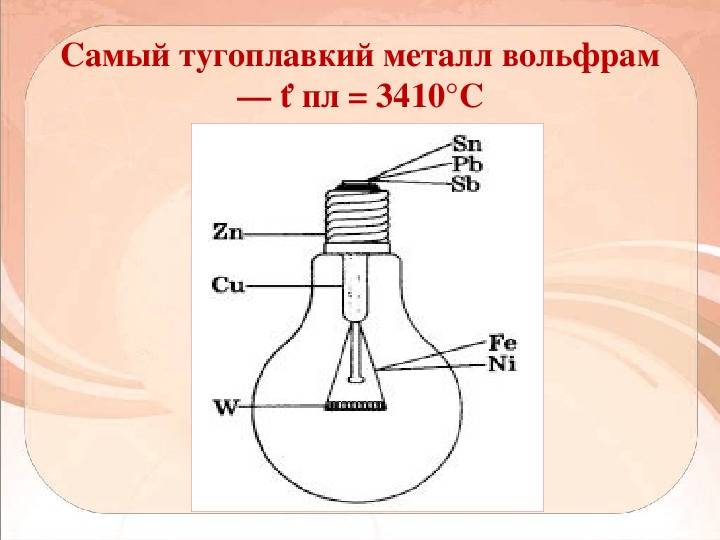
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
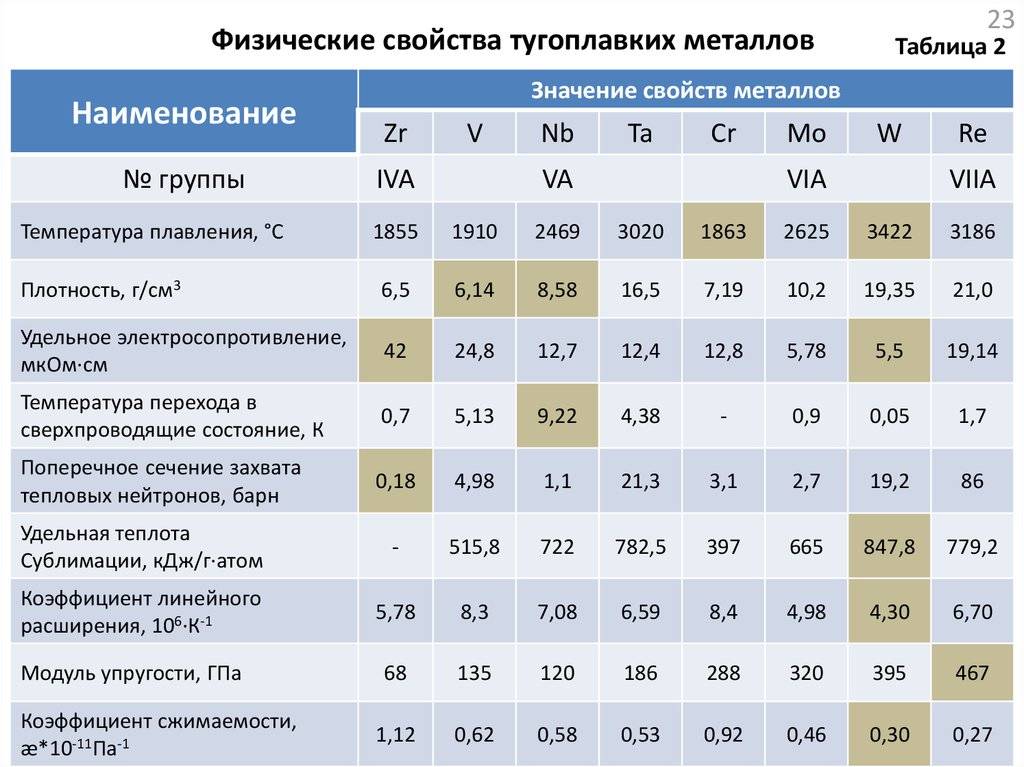
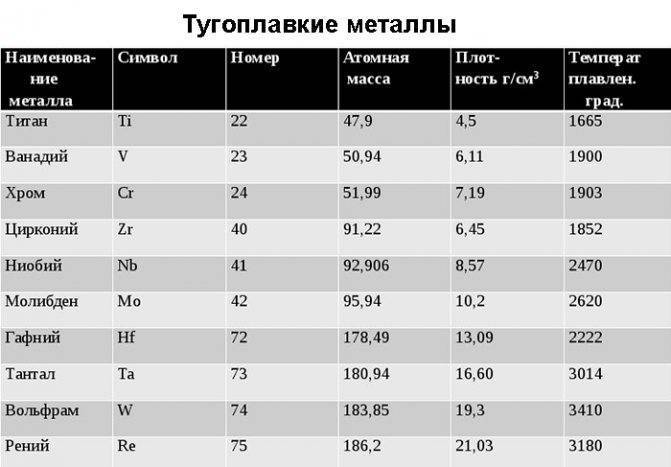
Свойства тугоплавких металлов
За счёт того, что они расположены в соседних группах периодической таблицы, физические свойства у тугоплавких металлов достаточно близкие:
- Плотность металла колеблется в интервале от 6100 до 10000 кг/м3. По этому показателю выделяется только вольфрам. У него он равен 19000 кг/м3.
- Температура плавления. Она превышает температуру плавления железа и колеблется от 1950 °С у ванадия до 3395 °С у вольфрама.
- Удельная теплоёмкость у них незначительно отличается друг от друга и находится в пределах от 200 до 400 Дж/(кг-град).
- Коэффициент теплопроводности сильно меняется от элемента к элементу. Если у ванадия он равен 31 Вт/(м-град), то у вольфрама он достигает величины в 188 Вт/(м-град).
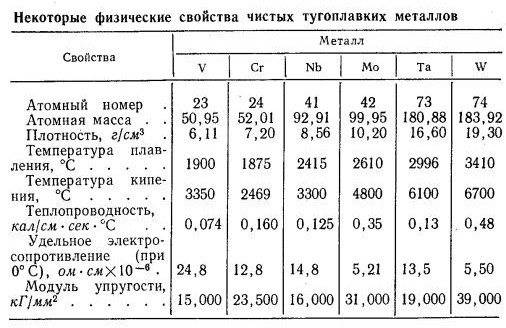
Физические свойства тугоплавких металлов
Химические свойства также достаточно схожие:
- Очень похожее строение атома.
- Обладают высокой химической активностью. Это свойство определяет основные трудности при сохранении стабильности их соединений.
- Прочность межатомных связей определяет высокую температуру плавления. Это обстоятельство объясняет высокую механическую прочность, твёрдость и электрические характеристики (в частности сопротивление).
- Проявляют хорошую устойчивость при воздействии различных кислот.
К основным недостаткам тугоплавких металлов относятся:
- Низкая коррозийная стойкость. Процесс окисления происходит достаточно быстро. Его разделяют на две последовательные стадии. Непосредственное взаимодействие металла с кислородом окружающего воздуха, что приводит к образованию оксидной плёнки. На второй стадии происходит процесс диффузии (проникновения) атомов кислорода через образовавшуюся оксидную плёнку.
- Трудности со свариваемостью тугоплавких металлов. Это вызвано высокой химической активностью к окружающему воздуху при высоких температурах, хрупкостью при насыщении различными примесями. Кроме того, трудно определить точку перегрева и практически невозможно контролировать повышение предела текучести.
- Трудности их получения использования в чистом виде без примесей.
- Необходимость применения специальных покрытий от быстрого окисления. Для сплавов, основу которых составляет вольфрам и молибден, разработаны силицидные покрытия.
- Трудности, связанные с механической обработкой. Для качественной обработки их сначала необходимо нагреть.
Какой металл считается самым тугоплавким

Металл с давних времён используются человеком в различных сферах деятельности
Чтобы получить качественное металлическое изделие, важно подобрать хороший материал, оценивая при этом его характеристики. Важный параметр — тугоплавкость
Для изготовления некоторых изделий подходят только самые тугоплавкие металлы.
Определение
Тугоплавкий металл — отдельный класс, к которому относятся металлические заготовки, выдерживающие воздействие критически высоких температур. Обычно у представителей этого класса температура плавления более 1600 градусов, что считается точкой плавления железа. К ним относят благородные сплавы. Их ещё называют представителями платиновой группы.
Свойства
Чтобы понимать, где лучше использовать материал, нужно знать свойства тугоплавких металлов. Из них изготавливаются детали для промышленного оборудования, техники и электроники. Характеристики тяжелых тугоплавких металлов будут описаны ниже.
Физические свойства
Характеристики:
- Плотность — до 10000 кг/м3. У вольфрама этот показатель достигает 19000 кг/м3.
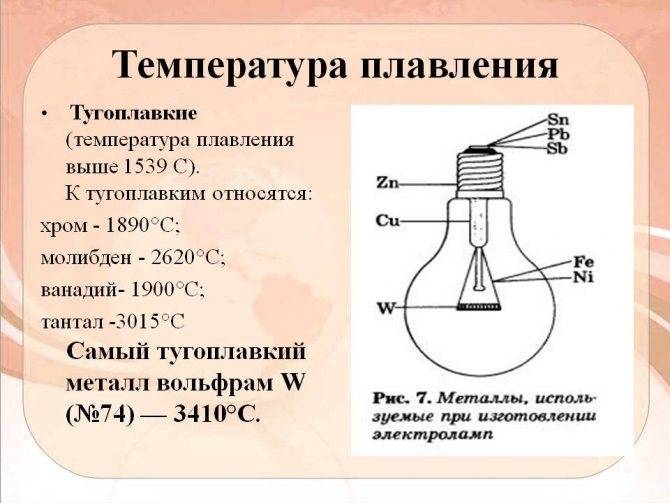
- Средняя температура плавления — 2500 градусов по Цельсию. Самая высокая температура плавления металла у вольфрама — 3390 градусов.
- Удельная теплоёмкость — 400 Дж.
Тугоплавкие предметы не выдерживают ударов и падений.
Химические свойства
Химические свойства:
- Это твердые вещества, обладающие высокой химической активностью.
- Прочная межатомная структура.
- Сопротивляемость длительному воздействию кислот и щелочей.
- Высокий показатель парамагнитности.
Эти материалы имеют некоторые недостатки. Главным из них является трудный процесс обработки и изготовления продукции из него.
Применение
Изначально тугоплавкие металлы использовались при изготовлении конденсаторов и транзисторов для радиоэлектроники. Количество их сфер применения увеличилось только к середине 20 века. Промышленной комплекс расширился до изготовления деталей для станков, автомобилей, самолётов и ракет.
Сплавы, выдерживающие воздействие критических температур, начали использоваться для изготовления посуды. Тугоплавкие металлы применяются в процессе производства строительных и соединительных материалов. Из них делают детали для бытовых приборов и электроники.
Самым тугоплавким считается вольфрам. Его температура плавления в 3390 градусов превышает показатели других материалов. Однако нельзя забывать про то, что при падении вольфрамовой детали с высоты, она треснет или разобьётся на отдельные части.Вольфрам — Самый ТУГОПЛАВКИЙ Металл На ЗЕМЛЕ! Остальные материалы с высоким показателем плавления, немногим отличаются от вольфрама. Используются в машиностроении, кораблестроении, ядерной энергетики, изготовлении промышленного оборудования. Их разработка и исследование продолжается и по сей день.
Какой металл считается самым тугоплавким Ссылка на основную публикацию
Классификация
В зависимости от температуры плавления тугоплавкие металлы причисляются к основной либо дополнительной группе.
Основная группа
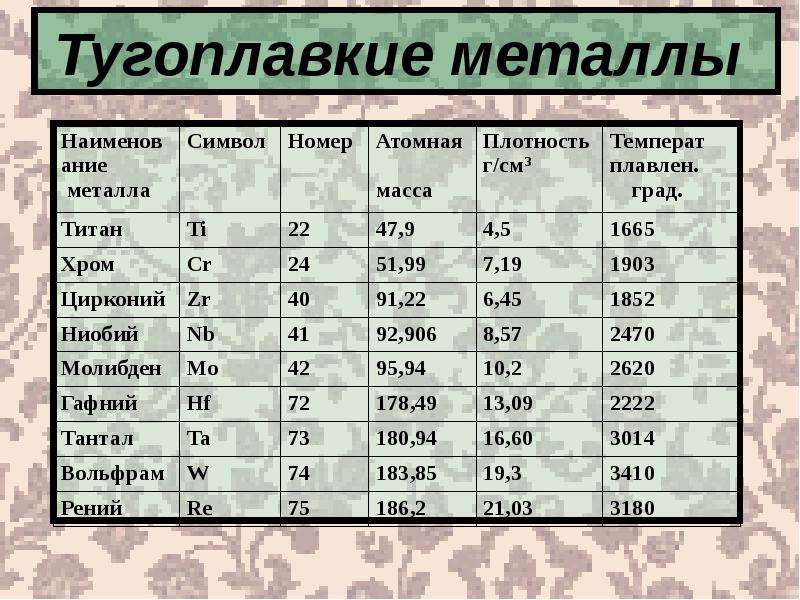
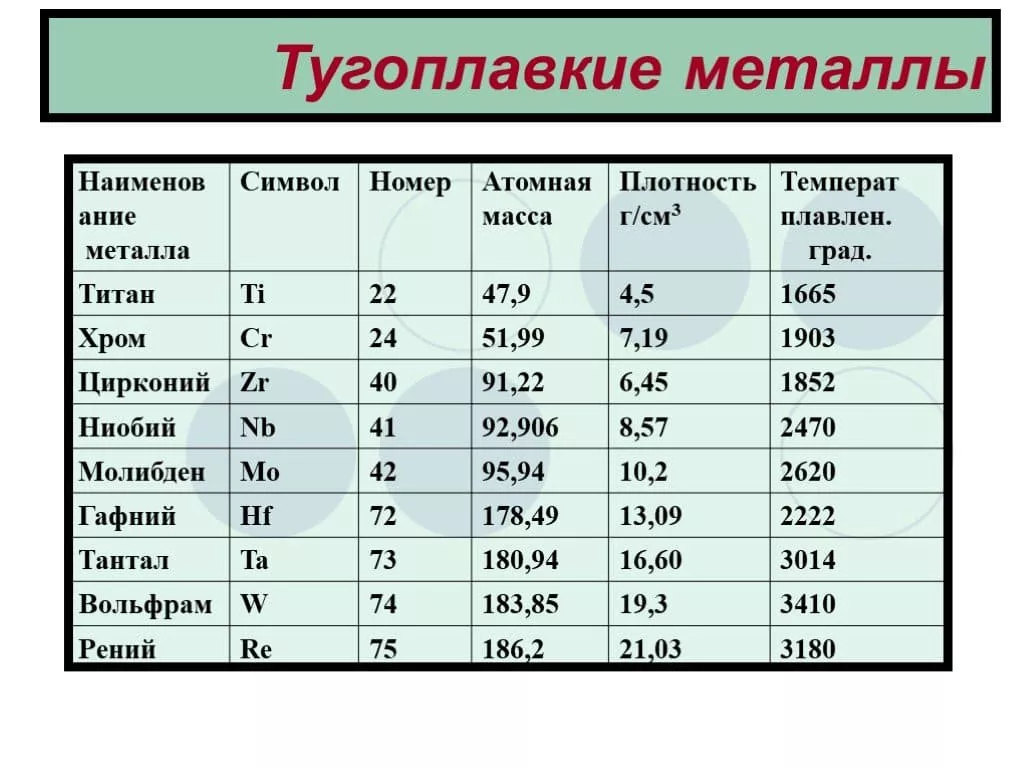
Данный сегмент включает пять позиций: вольфрам, ниобий, тантал, молибден, рений. Плавятся при 2200°С+.
| Название | Ниобий | Молибден | Тантал | Вольфрам | Рений |
|---|---|---|---|---|---|
| Температура плавления | 2750 K (2477 °C) | 2896 K (2623 °C) | 3290 K (3017 °C) | 3695 K (3422 °C) | 3459 K (3186 °C) |
| Температура кипения | 5017 K (4744 °C) | 4912 K (4639 °C) | 5731 K (5458 °C) | 5828 K (5555 °C) | 5869 K (5596 °C) |
| Плотность | 8,57 г·см³ | 10,28 г·см³ | 16,69 г·см³ | 19,25 г·см³ | 21,02 г·см³ |
| Модуль Юнга | 105 ГПа | 329 ГПа | 186 ГПа | 411 ГПа | 463 ГПа |
| Твёрдость по Виккерсу | 1320 МПа | 1530 МПа | 873 МПа | 3430 МПа | 2450 МПа |
Молибден
Самый востребованный из тугоплавких элементов.

Сфера использования номер один – металлургия:
- Молибденом «усиливают» сталь, чтобы получить твердый сплав.
- На пару с нержавеющей сталью применяют как материал инфраструктуры трубопроводов, деталей автомобилей, другой продукции машиностроения.
- Благодаря температуре плавления, износостойкости, малой истираемости используется как легирующая присадка.
Например, полпроцента титана плюс 0,08% циркония создают молибденовый сплав, не снижающий прочность до 1060°C.
Неординарные параметры по трению обусловили использование молибдена как долговечной смазки с высоким КПД.

Материал незаменим для ртутных реле, поскольку амальгама с данным металлом ртутью не формируется.
Вольфрам
Открыт в конце 18 века. Самый твердый и самый тугоплавкий (3422°C) металл.
 Тугоплавкий прочный металл, светло-серого цвета – вольфрам
Тугоплавкий прочный металл, светло-серого цвета – вольфрам
Вместе с медью и железом используется как основа (до 80%) сплавов с рением, торием, никелем. Такие добавки повышают плотность, порог стойкости к ржавлению, надежность.
Востребован как материал систем электроснабжения, приборов, боеприпасов, ядерных боеголовок ракет. Никелевые сплавы как материал клюшек ценят поклонники гольфа.
 Вольфрам в слитках
Вольфрам в слитках
Тантал
Самый стойкий к кислотам, коррозии из сегмента тугоплавких металлов.
 Тяжёлый твёрдый металл серого цвета – тантал
Тяжёлый твёрдый металл серого цвета – тантал
Поэтому используется в конденсаторах смартфонов, планшетов, других гаджетов.
Совместим с биологическими организмами (не меняется под воздействием природных кислот). Благодаря этому применяется медициной.
Ниобий
Металл с небанальными характеристиками:
- Самый легкий (малой плотности) в сегменте.
- Уникален благодаря свойству менять коэффициент твердости и упругости в зависимости от степени отжига.
- Самый частый в сплавах-суперпроводниках.

Применяется как материал конденсаторов, газовых турбин ракет, самолетов. А также элемент ядерных реакторов и ламп электронных приборов.
Рений
Самый редкий и дорогой из тугоплавких металлов:
- В сплавах выступает легирующим, никогда – основным компонентом.
- Как лигатура, повышает утилитарные кондиции сплава: прочность, ковкость (например, с медью и платиной).
- Обнаружен последним в тугоплавком сегменте.

Сплавы с рением служат катализаторами, начинкой электронного оборудования, гироскопов, реакторов атомных объектов.
Дополнительная группа
Данный сегмент тугоплавких металлов включает девять позиций. Их общий признак – порог плавления от 1850°C.
Сюда зачислены девять элементов из трех групп (четвертый – шестой периоды) таблицы Менделеева.
У каждого своя «изюминка»:
- Осмий – самое плотное вещество планеты, самый тяжелый тугоплав.
- Иридий встречается чаще в метеоритах, чем на Земле.
- Метаморфозы теплоемкости гафния необъяснимы наукой до сих пор.
- Рутений назван в честь России.
- Из чистого ванадия вытачивают жетоны и медали для коллекционеров.
- Титан – единственный тугоплавкий цветной металл. Материал зубных и костных протезов.
- Без циркония невозможны салюты и фейерверки. Медицинский «дублер» титана.
Тонким слоем хрома и благородного родия покрывают поверхность изделий класса люкс, включая ювелирные. Процессы называются хромированием и родированием.
Самый тугоплавкий металл в мире — свойства, получение, применение
Определение «тугоплавкие металлы» не требует дополнительных пояснений в силу исчерпывающей информативности самого термина. Единственным нюансом остается пороговая температура плавления, после которой вещество можно считать тугоплавким.
Где применяется вольфрам?
Широко используют соединения вольфрама. Их применяют в машиностроительной и горнодобывающей промышленностях, для бурения скважин. Из данного металла благодаря его высокой прочности и твердости изготавливают детали двигателей летательных аппаратов, нити накаливания, артиллерийские снаряды, сверхскоростные роторы гироскопов, пули и т.д. Также вольфрам успешно применяется как электрод при аргонно-дуговой сварке. Не обходятся и такие отрасли промышленности без соединений вольфрама – текстильная, лакокрасочная.
Определение
Большинство определений термина тугоплавкие металлы
определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000°F (2,200°C ). Это необходимо для их определения как тугоплавких металлов.
Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий.
Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
Сравнительная таблица степени тугоплавкости чистых металлов
Следует отметить, что тугоплавкие материалы не ограничиваются исключительно металлами. К этой категории относится ряд соединений – сплавы и легированные металлы, разработанных, чтобы улучшить определенные характеристики исходного материала.
Относительно чистых элементов, можно привести наглядную таблицу степени их температурной устойчивости. Возглавляет ее самый тугоплавкий металл, известный на сегодня, – вольфрам с температурой плавления 3422 0С. Такая осторожная формулировка связана с попытками выделить металлы, обладающие порогом расплава, превосходящим вольфрам.
Поэтому вопрос, какой металл самый тугоплавкий, может в будущем получить совсем иное определение.
Пороговые величины остальных соединений приведены ниже:
- рений 3186;
- осмий 3027;
- тантал 3014;
- молибден 2623;
- ниобий 2477;
- иридий 2446;
- рутений 2334;
- гафний 2233;
- родий 1964;
- ванадий 1910;
- хром 1907;
- цирконий 1855;
- титан 1668.
Остается добавить еще один интересный факт, касающийся физических свойств жапропрочных элементов. Температура плавления некоторых из них чувствительная к чистоте материала. Ярким примером этому выступает хром, температура плавления которого может варьироваться от 1513 до 1920 0С, в зависимости от химического состава примесей. Поэтому, данные интернет пространства часто разнятся точными цифрами, однако качественная составляющая от этого не страдает.
Хром в чистом виде
Свойства самых тугоплавких металлов
Так самый тугоплавкий металл в мире (вольфрам) обычно легируется рением, торием, никелем при участии меди и/или железа. Первый делает сплав более коррозионстойким, второй — более надежным, а третий — придает небывалую плотность
Следует обратить внимание, что во всех сплавах вольфрама содержится не более 4/5
Из-за того, что вольфрам одновременно и твердый, и тугоплавкий его обычно применяют в электроснабжении, строении приборов, изготовлении оружия, снарядов, боеголовок и ракет. Более плотные сплавы (на базе никеля) применяют для производства клюшек для игры в гольф. Вольфрам образует и так называемые псевдосплавы. Дело в том, что в них металл не легируется, а наполняется жидким серебром или медью.
За счет разницы в температурах расплава получаются лучшие тепло и электропроводные свойства.
Это дает возможность использовать его для изготовления форм для литья цинковых деталей. Особое направления использования молибдена — в качестве легирующего элемента в стальных сплавах. Сплавы сталь+молибден обладают хорошей износостойкостью и невысокими показателями трения.
Сталь+молибден применяют в для изготовления труб, трубных конструкций, автомобиле и машиностроении.
Тугоплавкие металлы и сплавы
Однако исследования не стоят на месте, а потому сейчас большинство свойств тугоплавких элементов можно скорректировать путем их легирования, то есть получения сплавов. Сплавы на основе неплавких металлов сохраняют свою непревзойденную устойчивость к воздействия высоких температур и сопротивление к деформированию. При этом они еще и приобретают такие полезные свойства, как большая или меньшая пластичность, коррозионостойкость, жаропрочность, упругость и пр.
Две трети всех неплавких металлов получают из руды, а точнее их так называемых рудных концентратов. Это значит, что помимо основного элемента в руде находится множество вспомогательных. Прежде чем получится хоть грамм тугоплавкого элемента необходимо кон, химически очистить от всего ненужного, а затем восстановить или, как еще говорят, рафинировать. В зависимости от того, насколько чистый металл нужен, используют дугообразную, электронно-лучевую или плазменную плавку. В последней получаются металлы самого лучшего вида. Готовые тугоплавкие металлоэлементы представляют собой порошок или гранулы, правда иногда их сразу подвергают обработке и получают тугоплавкие заготовки — листы, пленку, трубы, нити и пр. Получением как заготовок, так и чистых металлов занимаются заводы тугоплавких металлов и сплавов. Один из старейших в России — ОАО «Опытный завод тугоплавких металлов и твёрдых сплавов» — работает в данной сфере с 48-го года XX века. Еще один советский, а ныне Узбекский , существует с 1956 года.
Применение тугоплавких металлов основано на максимально эффективном использовании их природных свойств. Среди отраслей народного хозяйства, прибегающих к помощи тугоплавких металлоэлементов, можно выделить строительство машин, судов, космических аппаратов и их деталей, атомную энергетику, ядерную промышленность и химическую промышленность, электроснабжение и металлургию. При этом практически нигде тугоплавкие металлоэлементы не используются «в живую», обычно для этих целей берут их различные сплавы.