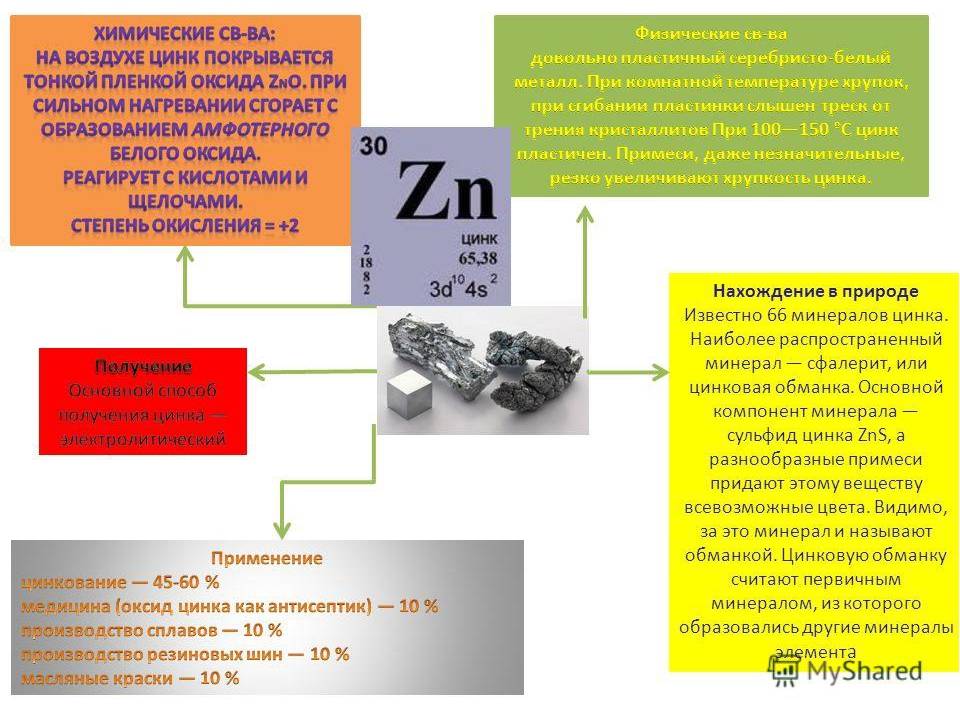
Факторы, влияющие на содержание в продуктах цинка
Варить, жарить, хранить пищу можно без ущерба содержанию в ней цинка. Однако некоторые виды обработки все же лишают пищу этого ценного элемента. Например, при изготовлении муки (размол крупы) теряется до 80% минерала. Кроме того, цинк удаляется из пищи в процессе рафинирования продуктов.
Почему возникает дефицит цинка
Среди причин недостатка минерала называют следующие:
• Заболевания, сопровождающиеся усиленным потоотделением
• Высокие нагрузки
• Прием мочегонных средств
• Патология органов пищеварения, препятствующая нормальному всасыванию ценных элементов
• Злоупотребление алкоголем
• Интенсивное потребление углеводов
• Послеоперационные состояния, парентеральное питание, различные виды ожогов
• Дисбактериоз
• Псориаз и другие заболевания кожи
• Наличие у человека кишечных паразитов.
Фармакологические возможности
Общеукрепляющее действие средства достигается благодаря компенсации недостатка данного микроэлемента в организме и его активном участии в метаболических процессах.
Металл является участником работы более 80 ферментных систем, участвующих в регуляции жизнедеятельности организма. Это делает элемент незаменимым для поддержания нормальных функциональных возможностей тела и улучшения его общего состояния.
Дефицит нутриента приводит к нарушениям метаболизма ретинола, ухудшению аппетита, снижению работоспособности, функций памяти, половой функции у мужчин, повышается утомляемость, уровень холестерина, риск развития атеросклероза, аллергических реакций, инфекционных болезней и ревматизма.
Микроэлемент участвует в процессах регенерации, обеспечивая постоянное самообновление организма. Особенно значимой для сохранения молодости и красоты является роль средства в синтезе белков, что позволяет укрепить ногти, волосы, сделать эластичной и упругой кожу, а также способность защищать клетки от воздействия свободных радикалов.
Также металл помогает регулировать функционирование предстательной железы, поддерживая нормальную работу мочеполовой системы у мужчин.
Отмечается роль элемента в формировании костей и активности нейронов мозга.
От количества металла в организме зависит его способность выделять тимулин фактор, влияющий на количество и активность Т-лимфоцитов и нейтрофилов, формирующих иммунные реакции на вторжение болезнетворных агентов.
Получение металла
Реакция жесткого окисления карбоната или сульфида цинка приводит к получениюего оксида. Процесс происходит в кипящем слое. Это специальный метод, основанный на тесном контакте мелкоизмельченного минерала и струи горячего воздуха, движущейся с большой скоростью. Далее оксид цинка ZnO восстанавливают коксом и удаляют образовавшиеся пары металла из сферы реакции. Еще один способ получения металла, основанный на химических свойствах цинка и его соединений – это электролиз раствора сульфата цинка. Он представляет собой окислительно-восстановительную реакцию, проходящую под действием электрического тока. Металл высокой чистоты при этом осаждается на электроде.
Особенности выплавки

оо
Цинк получают из полиметаллических руд, в которых может содержаться до 4% элемента. Если руды были обогащены селективной флотацией, из них можно получить до 60% цинковых концентратов, остальное будет занято концентратами других металлов. Цинковые концентраты обжигают в печах в кипящем слое, после чего сульфид цинка переходит в оксид, и выделяется сернистый газ. Последний идет в расход: из него получают серную кислоту.
Чтобы перевести оксид цинка в сам металл, используют два способа.
- Дистилляционный или пирометаллургический. Концентрат обжигают, затем подвергают спеканию, чтобы придать газопроницаемости и зернистости и восстанавливают при помощи кокса или угля при воздействии температуры в 1200-1300 C о. Во время реакции образуются пары металла, который конденсируют и разливают в изложницы. Чистота цинка достигает 98,7%, после можно повысить ее до 99,995% при помощи ректификации, но последний способ достаточно дорогой и сложный.
- Электролитический или гидрометаллургический. Обожженные концентраты обрабатывают серной кислотой, раствор очищают от примесей при помощи цинковой пыли и подвергают электролизу в выложенных изнутри свинцом или винипластом ваннах. Цинк оседает на алюминиевых катодах, откуда его собирают и плавят в индукционных печах. Чистота металла, полученного этим способом, достигает 99,95%.
Карбоангидраза и карбоксипептидаза
Считается, что цинк входит в состав 10% всех ферментов в организме человека, примерно 300 ферментов. Среди них можно отметить карбоангидразу и карбоксипептидазу.
Карбоангидраза, цинк-зависимый фермент, действует на тканевом уровне, катализируя реакцию углекислого газа с водой с образованием бикарбоната. Когда бикарбонат достигает легких, фермент меняет реакцию, и образуется углекислый газ, который выводится наружу во время выдоха.
Карбоксипептидаза – это экзопептидаза, которая переваривает белки с высвобождением аминокислот. Цинк обеспечивает положительный заряд, который облегчает взаимодействие фермента с перевариваемым белком.
Сырье для получения цинка
Основным источником получения цинка являются сульфидные, медно-свинцово-цинковые, медно-цинковые и свинцово-цинковые руды.
В сульфидных рудах цинк обычно присутствует в виде сфалерита или вуртцита, состав которых отвечает формуле ZnS, и марматита nZnS · mFeS. Спутниками цинка в полиметаллических рудах являются минералы и элементы.
В окисленных зонах месторождений цинксодержащих руд основными кислородсодержащими минералами цинка являются: смитсонит ZnCO3, цинкит ZnO и каламин ZnO·SiO2 ·H2O. Окисленные цинковые руды в настоящее время имеют подчиненное значение.
В сульфидных полиметаллических рудах содержание цинка обычно составляет 1…3 %. Эти руды имеют сложный состав. Все это обусловливает необходимость проведения предварительного обогащения руд по селективной схеме с получением нескольких концентратов.
Цинковые концентраты селективного флотационного обогащения полиметаллических руд содержат, %: Zn – 48…60; Pb – 1,5…2,5; Cu – 1…3; Cd – до 0,25; Fe – 3…10; S – 30…38, пустой породы – до 10.
Цинковые концентраты – комплексное дорогостоящее сырьё. Из них нужно извлекать цинк, свинец, медь, кадмий, серу, золото, серебро, ртуть, галлий, индий, таллий, селен, теллур и др.
Иногда при обогащении труднообогатимых медно-цинковых руд получают промежуточные продукты, содержащие 12…18 % Zn и 4…8 % Cu. Переработка этих материалов затруднена как на цинковых, так и на медных заводах.
Переработку цинковых концентратов в настоящее время осуществляют двумя методами – пирометаллургическим и гидрометаллургическим.
В основе пирометаллургического способа лежит процесс восстановления оксида цинка при 1000…1100 ºС, т. е. при температуре выше точки кипения металлического цинка, что обеспечивает выделение его в момент образования в парообразном состоянии и возгонку в виде паров:
ZnO + C = Znпар + CO; ZnO + CO = Znпар + CO2.
Пары цинка в дальнейшем конденсируют. Получение жидкого цинка дистилляцией возможно только в условиях сильно восстановительной атмосферы и полной герметизации применяемой аппаратуры.
В связи с тем что цинковый концентрат представляет собой сульфидный материал, а восстановление цинка возможно только из его оксида, дистилляции предшествует окислительный обжиг с полным удалением серы.
Возможны несколько вариантов аппаратурного оформления пирометаллургического способа получения цинка: в горизонтальных и вертикальных ретортах, в шахтных и электрических печах. Принцип действия положен в основу получения паров цинка в электротермической части кивцетного агрегата.
Получающийся пирометаллургическим способом цинк обязательно содержит большое количество металлов-примесей, возгоняемых вместе с ним или попадающих в него из выносимой газами пыли. Поэтому дистилляционный цинк, как и всякий черновой металл, нуждается в рафинировании.
Пирометаллургический способ применяют с момента возникновения цинкового производства. Доля выпуска цинка этим способом из года в год сокращается и в настоящее время составляет не более 20 %.
Гидрометаллургический способ является в настоящее время основным. Широкое распространение гидрометаллургии при производстве цинка обусловлено ее значительными преимуществами по сравнению с дистилляцией. К ним относятся:
- извлечение большего количества цинка и сопутствующих элементов;
- большая комплексность использования сырья;
- высокое качество цинка;
- высокая механизация трудоемких процессов.
По этому способу цинк выщелачивают раствором серной кислоты из предварительно обожженного концентрата. При выщелачивании цинк переходит в раствор в виде сернокислого цинка по реакции
ZnO + H2SO4 = ZnSO4 + H2O.
При выщелачивании цинкового огарка в раствор частично переходят содержащиеся в нем компоненты. Качество получаемого электролитическим осаждением цинка зависит от чистоты раствора: чем чище раствор, поступающий на электролиз, тем более чистым получается товарный цинк. Поэтому перед электролизом раствор тщательно очищают от примесей.
Процесс электролитического осаждения цинка из очищенного раствора протекает по следующей суммарной реакции:
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
Цинк при электролизе осаждается на катоде, а на аноде регенерируется серная кислота, необходимая для выщелачивания свежих порций огарка, и выделяется кислород. Катодные осадки цинка переплавляют и разливают в слитки.
Кек (нерастворенный осадок), получаемый после выщелачивания, подвергают дополнительной переработке с целью доизвлечения из него цинка и других ценных компонентов.
Цинк: производство
Главное сырье для добычи цинка – это полиметаллическая руда, содержащая сульфид Zn в количестве 1-4 %. В дальнейшем это сырьё обогащается селективной флотацией, позволяющей получить цинковый концентрат (до 50-60 % Zn). Его помещают в печи, превращая сульфид в оксид ZnO. Затем обычно применяется дистилляционный (пирометаллургический) способ получения чистого Zn: концентрат обжигается и спекается до состояния зернистости и газопроницаемости, после чего восстанавливается коксом или углем при температуре 1200-1300°C. Простая формула показывает, как из оксида цинка получить цинк:
ZnO+С=Zn+CO
Данный способ позволяет добиться 98,7-процентной чистоты металла. Если же необходима чистота в 99,995%, применяется технологически более сложная очистка концентрата ректификацией.

Динамика цен на цинк, прогноз на 2018 год
С начала года прослеживается общая отрицательная динамика цен на цинк. Если в феврале 2021 года за тонну металла давали 3577,25 долларов, то по состоянию на 18 мая Лондонская Биржа Металлов (LME) установила курс цинка, равный 3096,50 долларов.
В 2021 году цинк имел статус самого доходного и подходящего для инвестиций металла. В 2021 году отметилась тенденция к снижению инвестиционной привлекательности данного элемента. При этом большинство аналитиков полагают, что цинк в 2021 останется лидером среди цветных металлов.
Deutsche Bank дает прогноз по цинку, в котором предполагается рост цены на металл на 8%. В ближайшие месяцы прогнозируется стоимость тонны металла в пределах 3120-3160 долларов.
Биологическая роль
В организме взрослого человека содержится в среднем около 2 г цинка, в виде его соединений, который концентрируется преимущественно в мышцах, печени и поджелудочной железе. Более 400 ферментов содержат цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных эфиров, образование альдегидов, полимеризацию ДНК и РНК. Ионы Zn2+ в составе ферментов вызывают поляризацию молекул воды и органических веществ, содействуя их депротонированию по реакции:
- Zn2+ + H2O = ZnOH+ + H+
Наиболее изучен фермент карбоангидраза — белок, содержащий цинк и состоящий примерно из 260 аминокислотных остатков. Этот фермент содержится в эритроцитах крови и способствует превращению углекислого газа, образующегося в тканях в процессе их жизнедеятельности, в гидрокарбонат-ионы и угольную кислоту, которая кровью переносится в легкие, где выводится из организма в виде углекислого газа. В отсутствие фермента превращение CO2 в анион HCO3– протекает с очень низкой скоростью. В молекуле карбоангидразы атом цинка связан с тремя имидазольными группами остатков аминокислоты гистидина и молекулой воды, которая легко депротонируется, превращаясь в координированный гидроксид. Атом углерода молекулы углекислого газа, на котором находится частичный положительный заряд, вступает во взаимодействие с атомом кислорода гидроксильной группы. Таким образом, координированная молекула CO2 превращается в гидрокарбонат-анион, который покидает активный центр фермента, замещаясь на молекулу воды. Фермент ускоряет эту реакцию гидролиза в 10 миллионов раз.
Цинк:
- необходим для продукции спермы и мужских гормонов
- необходим для метаболизма витамина E.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.
Содержание в продуктах питания
Рекомендуемая дневная норма цинка в рационе — 11 мг для мужчин и 8 мг для женщин. Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах, тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде.
Содержание цинка в продуктах на 100 г:
- Орехи и семечки: тыквенные семечки — 10 мг, кунжут — 7 мг, семена подсолнечника — 5,3 мг, миндаль — 3 мг, грецкие орехи — 3 мг.
- Мясо: говяжья печень — 4 мг, говядина — 3—8,4 мг, баранина — 2—6 мг, курица — 0,8—3,5 мг, свинина — 0,8—3,5 мг.
- Бобовые: чечевица — 4,78 мг, арахис — 4 мг, горох — 1,2 мг, соевые бобы — 3 мг.
- Молочные продукты: твёрдый сыр — 3—4 мг, мороженое, йогурт — 0,7—0,8 мг, молоко — 0,4 мг.
- Злаки и хлеб: овёс — 3,97, пшеница — 3,46 мг, рожь — 2,65 мг, рис — 1 мг, хлеб — 0,7—1,5 мг, печенье — 0,5—1 мг, мука пшеничная — 0,8 мг.
- Рыба и морепродукты: устрицы — 16—40 мг, анчоусы — 1,72 мг, осьминог — 1,68 мг, карп — 1,48 мг, икра — 1 мг, сельдь — 0,99 мг.
- Овощи и фрукты: зелёный горошек — 1,24 мг, ростки бамбука — 1,10 мг, кукуруза (варёная, консервированная) — 0,5—0,6 мг, финики — 0,44 мг, малина — 0,42 мг, брокколи — 0,41 мг, свёкла — 0,35 мг, картофель — 0,29 мг, чёрная смородина — 0,27 мг, инжир, бананы — 0,15 мг, апельсины — 0,07 мг, грейпфрут — 0,07 мг, лимоны — 0,06 мг, яблоки — 0,04 мг.
- Сладости: какао-порошок (неподслащенный) — 6,81 мг, шоколад — 2,3 мг, шоколадные конфеты — 1—2 мг, мёд — 0,22 мг.
Также цинк может присутствовать в минеральной воде.
Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие.
Для оценки содержания цинка в организме определяют его содержание в волосах, крови и её сыворотке.
Оксид цинка
Белый пористый порошок, желтеющий при нагревании и возвращающий свой первоначальный цвет при охлаждении – это окись металла. Химические свойства оксида цинка, уравнения реакций его взаимодействия с кислотами и щелочами подтверждают амфотерный характер соединения. Так, вещество не может реагировать с водой, но взаимодействует как с кислотами, так и со щелочами. Продуктами реакций будут средние соли (в случае взаимодействия с кислотами) или комплексные соединения – тетрагидроксоцинкаты.
Оксид цинка применяют в производстве белой краски, которую называют цинковыми белилами. В дерматологии вещество входит в состав мазей, присыпок и паст, оказывающих на кожу противовоспалительное и подсушивающее действие. Большая же часть производимого оксида цинка применяется в качестве наполнителя для резины. Продолжая изучать химические свойства цинка и его соединений, рассмотрим гидроксид Zn(OH)2.

Где применяется
Свойства металла, его сплавов, соединений обусловили их использование в металлургии, электротехнике, медицине.
Чистый металл
Основные направления:
- Отрицательный электрод батареек, аккумуляторов.
- Восстановитель благородных металлов.
- Защитное покрытие стали от коррозии.
- Компонент твердых припоев для повышения легкоплавкости.
- Извлекатель металлов из чернового свинца.
До середины XX века популярной сферой применения цинка была полиграфия. Для создания черно-белых иллюстраций в газетах или книгах использовался метод цинкографии. На цинковой пластине кислотой вытравливалось изображение. Затем с нее на печатной машине делались оттиски.
 Слитки цинка
Слитки цинка
Сплавы
Цинк востребован как компонент сплавов с металлами. Например, латуни.
Она используется машиностроителями для точного литья:
- Автомобильная фурнитура.
- Оболочка карбюраторной коробки.
- Затворы травматических пистолетов.
Соединения
Применение нашли соединения металла, созданные природой или человеком:
- Хлорид – паяние металлов, изготовление фибры.
- Теллурид, селенид, фосфит – полупроводники.
- Селенид задействован при изготовлении специальных сортов стекла для лазеров.
- Окись – исходник для цинковых белил.
- Сульфид – компонент люминофоров (гибкие панели, экраны).
Фосфитом металла изничтожают грызунов.
Роль цинка в организме
Цинк участвует в клеточном метаболизме – этот микроэлемент необходим для работы более 300 ферментов. Кроме того, он участвует в правильном функционировании иммунной системы, синтезе белка, заживлении ран, синтезе ДНК и делении клеток.
Цинк также очень важен для беременных женщин, он необходим для правильного развития плода, а затем для развития и взросления ребенка. Его дефицит у детей может привести к задержке роста и полового созревания.
У взрослых слишком низкая концентрация цинка может привести к выпадению волос, ломкости ногтей и медленному заживлению ран. Этот элемент также важен для функционирования вкуса и обоняния.
Исследования показали, что у людей с диабетом уровень цинка ниже, чем у здоровых людей. Дефицит цинка связан с нарушением секреции инсулина бета-клетками поджелудочной железы, снижением чувствительности периферических тканей к инсулину и повышением уровня воспалительных маркеров в организме.
ПРИМЕНЕНИЕ
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Цинк (англ. Zinc) — Zn
| Молекулярный вес | 65.39 г/моль |
| Происхождение названия | Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Негативные последствия приема добавок цинка
Прием большого количества цинка в течение длительного периода времени может помешать поглощению организмом других важных минеров, например, меди. В результате это может привести к подавлению иммунной системы и нарушению формирования клеток крови.
Чаще всего при приеме умеренно высоких доз цинка возникают только кратковременные и незначительные симптомы. Некоторые люди, использующие цинк в форме спрея для носа или геля, отмечают изменения в способности чувствовать запах и вкус продуктов, что также может отразиться на аппетите. Помимо этого, цинк может вызывать тошноту, несварение желудка, диарею, колики в животе и рвоту. Как правило, такие побочные эффекты возникают в течение 3-10 часов с момента приема добавки. К счастью, после прекращения приема цинка все симптомы проходят достаточно быстро.
Изучить отзывы, а также купить цинк, можно в магазине iHerb.
Этот абзац содержит рекламную ссылку. Вы получите от нас скидку при оформлении первого заказа, а магазин выплатит нам небольшой процент от прибыли с вашей покупки. Это позволяет вам сэкономить, а нам поддерживать работу сайта и редакции. Спасибо!
ЗАПАСЫ И ДОБЫЧА
Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%), чем в кислых (6·10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом
Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим. Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах. Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.

Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s22s22p63s23p63d104s2.
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
История открытия
О существовании этого металла было известно еще в древние времена. Археологами найдены изделия, изготовленные из его сплавов, датируемые до нашей эры.
Сложность представлял только процесс получения чистого металла. Это обусловлено его низкой температурой кипения. Впервые задачу удалось решить в 1746 г. Немецкий химик А. С. Маргграф предложил следующую схему:
- В огнеупорной реторте прокаливалась смесь оксида этого металла с углем.
- Получившиеся пары поступали в холодильник и конденсировались.
Этот опыт считается моментом открытия чистого цинка. Хотя ряд источников указывает на то, что такую технологию в Индии знали еще в VII в. Путешественники, например Марко Поло, отражали в своих заметках, что встречали ее в Персии, Китае.
Цинковые литейные сплавы
Чистый или технический цинк хорошо обрабатывается прокатом, на штампах и другими методами обработки металла. Его можно обрабатывать как в холодном, так и в подогретом до 170 градусов, состоянии. Плотность цинка равна 7,13 кг на кубический дециметр. Кроме того, цинк обладает низкой температурой плавления – 420 градусов Цельсия. Металлургическая промышленность выпускает несколько сортов цинка, которые отличаются друг от друга набором примесей. Для маркировки цинковых сплавов применяют следующий набор букв и цифр. Буква Ц, обозначающую принадлежность материала к цинку. Затем указывают буквы А, М или другие, которые обозначают названия примесей А – алюминий, М – медь и пр. на третьем стоят цифры, указывающие на процентное содержание примеси.

Цинковые литейные сплавы
Для литья из цинка применяют сплавы ЦА4, ЦАМ4-1 их применяют для литья под давлением и многие другие. Состав и механические параметры антифрикционных сплавов определены в ГОСТ 21437-95.
К особенностям применения цинковых сплавов можно то, что вторичная плавка этого материала приводит к потере ими жидкотекучести.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м2.
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | – | 2,5 |
| * В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. |
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим
способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Признаки дефицита
Недостаток цинка в организме может быть обусловлен рядом причин: недостаточное поступление с пищей, плохое усвоение, нарушения в работе щитовидной железы, заболевания печени. Кроме того, поводом для дефицита этого макроэлемента может стать переизбыток белков, фитина и селена, употребляемых с продуктами питания. Причиной данной проблемы и снижения качества жизнедеятельности в целом также могут стать моральные и физические нагрузки, нестабильный образ жизни, стрессовые ситуации, вредные привычки.
Перерасход цинка в организме происходит при воспалениях и онкологии. Причина в том, что при лечении данных заболеваний, активируется рост клеток, в котором важную роль играет цинк.
Кроме перечисленных выше причин, дефицит цинка может быть вызван такими факторами:
- Интенсивное потоотделение.
- Злоупотребление алкоголем.
- Восстановление после операции.
- Парентеральное питание.
- Прием большой дозы мочегонных, костикостероидных средств и эстрогенов.
- Передозировка медью, кадмием, свинцом и ртутью.
- Наличие паразитов в кишечнике.
Структура и электронная конфигурация
Атомы цинка кристаллизуются в компактную, но искаженную гексагональную структуру (ГПУ), продукт их металлической связи. Валентные электроны, которые управляют такими взаимодействиями, в соответствии с электронной конфигурацией принадлежат 3d- и 4s-орбиталям:
3d10 4 с2
Обе орбитали полностью заполнены электронами, поэтому их перекрытие не очень эффективно, даже когда ядра цинка оказывают на них силу притяжения.
Следовательно, атомы Zn не очень связаны, что отражается в их низкой температуре плавления (419,53 ºC) по сравнению с другими переходными металлами. Фактически, это характеристика металлов 12 группы (наряду с ртутью и кадмием), поэтому они иногда задаются вопросом, действительно ли их следует считать элементами блока d.
Хотя орбитали 3d и 4s заполнены, цинк является хорошим проводником электричества; следовательно, его валентные электроны могут «прыгать» в зону проводимости.